
����Ŀ������ͭ��һ��Ӧ�ü���㷺�Ļ���ԭ�ϣ�������ij�����ú�����ͭΪԭ������������CuSO45H2O������������ʾ��ͼ�� 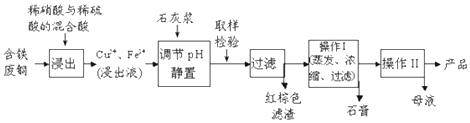
������ʯ���ڲ�ͬ�¶��µ��ܽ�ȣ�g/100gˮ��������
�¶ȣ��棩 | 20 | 40 | 60 | 80 | 100 |
ʯ�� | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
���� | 32 | 44.6 | 61.8 | 83.8 | 114 |
��ش��������⣺
��1������ɫ��������Ҫ�ɷ�����
��2��д��������������������ͭ�Ļ�ѧ����ʽ��
��3������I�IJ����¶�Ӧ�ÿ����������ң�
��4������Һ�з��������ͭ����IJ���IIӦΪϴ�ӡ����
��5����Ӧ�����е�NO����ѭ��ʹ�ã��Խ���һ����ѧ����ʽ��ʾNOת��ΪHNO3��
���𰸡�
��1��Fe��OH��3
��2��3Cu+2HNO3+3H2SO4=3CuSO4+2NO��+4H2O
��3��100
��4����ȴ�ᾧ������
��5��4NO+3O2+H2O=4HNO3
���������⣺�����ķ�ͭΪԭ�ϼ���ϡ�����ϡ����Ļ����Һ���ܽ��õ�����Һ���ڽ���Һ����Ҫ����Cu2+��Fe3+��H+��SO42�� �� ����ʯ�ҽ�������ҺPH���������ӣ����˵õ����ɫ����Ϊ������������������ʯ����������ܽ�ȣ�����100��C����Һ������ʯ�࣬��Һ����ҪΪ����ͭ��ͨ����������Ũ������ȴ�ᾧ������ϴ�ӣ�����õ�����ͭ���壻��1���ɹ�������ͼת����ϵ��֪������Һ�м���ʯ�ҽ�����pHֵ��������ת��ΪFe��OH��3�������������ɫ��������Ҫ�ɷ�ΪFe��OH��3 �� ���Դ��ǣ�Fe��OH��3����2����������Ĵ��ڣ��������������ȫ�����������ã���Ϊϡ��Һ����������ͭ��NO��ˮ����Ӧ����ʽΪ3Cu+2HNO3+3H2SO4=3CuSO4+2NO��+4H2O�����Դ��ǣ�3Cu+2HNO3+3H2SO4=3CuSO4+2NO��+4H2O����3���ɱ����ܽ�ȹ�ϵ��֪�������ܽ�����¶���������ʯ����ܽ�����¶����߽��ͣ�����Ӧ�����ڽϸߵ��¶ȣ��¶�Ӧ�ÿ�����100�棬�Ʊ��ĵ�����Խϴ���
���Դ��ǣ�100����4������Һ�з��������ͭ����ӦΪ������Һ��ȴ�ᾧ�����ˡ�ϴ�ӡ�������Դ��ǣ���ȴ�ᾧ�����ˣ���5��һ�����������ж���Ⱦ���������ŷŵ������У���������һ��������������ˮ��Һ��������������ѭ��ʹ�÷�Ӧ�Ļ�ѧ����ʽ4NO+3O2+H2O=4HNO3 �� ���Դ��ǣ�4NO+3O2+H2O=4HNO3 ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�������ͼ����Ϣ���ܳ��˵����Ӧ�Ļ�ѧ��Ӧ�Ƿ��ȷ�Ӧ���ǣ� ��
A�� | B�� | C�� | D�� | |
��Ӧ |
|
|
|
|
ʵ������ | �¶ȼƵ�ˮ������������ | ��Ӧ������������������������ | ��Ӧ��ʼ�״�Һ������Ҵ�Һ�� | ��Ӧ��ʼ����Ͳ���������ƶ� |
A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʢ��KI��Һ���Թ��м�������CCl4��μ���ˮ��CCl4������ɫ������������Թ��еμ���ˮ����CCl4�����dz���������ɫ��
���������գ�
��1��д������ƽCCl4������ɫ�����ɫ�Ļ�ѧ��Ӧ����ʽ�����ϵ����1��������д����++�T+
��2�����������еĻ�ԭ���� ��
��3����KI����KBr����CCl4���Ϊɫ�������μ���ˮ��CCl4�����ɫû�б仯��Cl2��HIO3��HBrO3��������ǿ������˳���� ��
��4���ӵ����к�����Ϊ20mg��50mg/kg����ȡ�ӵ��Σ���KIO3��ʳ�Σ�1000kg����ׯKl��Cl2��Ӧ��KIO3 �� ������Ҫ����Cl2L����״��������2λС������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ������ȼ�ϵ�أ������ö��Խ������缫����KOH��Һ�У�Ȼ���������Ϸֱ�ͨ�����������������ĵ缫��ӦΪ��X����CH4+10OH����8e��=CO32��+7H2O Y����2O2+4H2O+8e��=8OH�������ڴ�ȼ�ϵ�ص�˵������ȷ���ǣ� ��
A.�õ�ع���ʱͨ����һ��������Һ��pH����
B.����һ��ʱ���KOH�����ʵ�������
C.X������������Ӧ��Y��������ԭ��Ӧ
D.�ڱ�״����ͨ��5.6 L O2��ȫ��Ӧ������1 mol���ӷ���ת��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ�����壮�����ܱ������еķ�Ӧ��
N2��g��+3H2��g��2NH3��g������H��0����673K��30MPa�£�n��NH3����n��H2����ʱ��仯�Ĺ�ϵ��ͼ��ʾ��������ȷ���ǣ� ��
A.��d��t1ʱ�̣��͵�e��t2ʱ�̣���n��N2����һ��
B.��c����Ӧ�ﵽƽ��
C.��a������Ӧ���ʱȵ�b�Ĵ�
D.�����������䣬773 K�·�Ӧ��t1ʱ�̣�n��H2����ͼ��d���ֵС
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.���ȷ�Ӧ�ڳ����¶���������
B.���ȷ�Ӧ�����ȾͲ��ᷢ��
C.��Ҫ���Ȳ��ܷ����ķ�Ӧ�������ȷ�Ӧ
D.���ݷ�Ӧ����������������������Դ�С��ȷ����Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ѻӷ��Զ����㣨TaS2���ɲ�������װ���ᴿ����������TaS2��ĩװ��ʯӢ��һ�ˣ�����պ����������Ⲣ��ܣ����ڼ���¯�У���Ӧ���£�TaS2��s��+2I2��g��TaI4��g��+S2��g������˵����ȷ���ǣ� �� ![]()
A.�ڲ�ͬ�¶�����TaI4�������ֲ���
B.���ᴿ�����У�I2�������ϼ���
C.���ᴿ�����У�I2�������ǽ�TaS2�Ӹ�����ת�Ƶ�������
D.�÷�Ӧ��ƽ�ⳣ����TaI4��S2��Ũ�ȳ˻��ɷ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״���һ�ֿ������������Դ��һ����������CO��H2�ϳ�CH3OH��CO��g��+2H2 ��g��CH3OH��g����H=a kJmol��1 �� �����Ϊ2L���ܱ������г���2mol CO��4mol H2 �� ��ò�ͬ�¶������������������ʵ�����ʱ�䣨min���ı仯��ϵ��ͼ�Т�������ʾ�� 
��1�����жϷ�Ӧ�ﵽ��ѧƽ��״̬����������ĸ����
A.c��CO����c��H2���ı�ֵ���ֲ���
B.����������ѹǿ���ֲ���
C.�����������ܶȱ��ֲ���
D.��λʱ������1molCO���ĵ�ͬʱ��1mol CH3OH����
E.v����H2��=2v����CH3OH��
��2���٢�͢���ȣ���ı�ķ�Ӧ������ ��
�ڷ�Ӧ����9minʱ�ﵽƽ�⣬�ȽϷ�Ӧ����¶ȣ�T1���ͷ�Ӧ����¶ȣ�T3���ĸߵͣ�T1T3���������������=������������Ӧ����Ӧ������Ȼ����ȡ�����
��3���ٷ�Ӧ����6minʱ�ﵽƽ�⣬�ӷ�Ӧ��ʼ���ﵽƽ��ʱv ��CH3OH��=mol/��Lmin����
�ڷ�Ӧ����2minʱ�ﵽƽ�⣬������¶��µ�ƽ�ⳣ��K= �� ��������¶Ȳ���������£���������Ӧ�ﵽƽ���ʱ�����������м���1mol CO��3mol CH3OH��ƽ�⽫���������Ӧ���淴Ӧ�Ͳ��ƶ�������ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��
CH3CH2CH2CH3��g��+ ![]() O2��g���T4CO2��g��+5H2O��l����H=��2 878kJ/mol
O2��g���T4CO2��g��+5H2O��l����H=��2 878kJ/mol
��CH3��2CHCH3��g��+ ![]() O2��g���T4CO2��g��+5H2O��l����H=��2 869kJ/mol
O2��g���T4CO2��g��+5H2O��l����H=��2 869kJ/mol
����˵����ȷ���ǣ� ��
A.
���������춡���������С��ϵ��ͼ
B.��������ȶ��Դ����춡��
C.�춡��ת��Ϊ������Ĺ�����һ�����ȹ���
D.�춡������е�̼�����������Ķ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com