
下列物质的制备与工业生产相符的是
①NH3 NO
NO HNO3
HNO3
②浓HCl Cl2
Cl2 漂白粉
漂白粉
③MgCl2(aq) 无水MgCl2
无水MgCl2 Mg
Mg
④饱和NaCl(aq) NaHCO3
NaHCO3 Na2CO3
Na2CO3
⑤铝土矿  NaAlO2溶液
NaAlO2溶液 Al(OH)3
Al(OH)3 Al2O3
Al2O3 Al
Al
A.①④⑤ B.①③⑤ C.②③④ D.②④⑤
科目:高中化学 来源: 题型:
下列实验方案不可行或结论不正确的是
A.用润湿的pH试纸测定饱和Na2CO3溶液pH
B.通过观察右图中导管水柱的变化,验证铁钉生锈的原因主要是吸氧腐蚀
C.向Mg(OH)2悬浊液中滴加FeCl3溶液,出现红褐色沉淀,说明溶解度:Fe(OH)3<Mg(OH)2
D.相同温度下,向同浓度、同体积的醋酸和盐酸溶液中加入足量镁粉,比较同一时间产生H2的快慢来比较两种酸的强弱

查看答案和解析>>
科目:高中化学 来源: 题型:
化合物Ⅴ是中药黄芩中的主要活性成分之一,具有抗氧化和抗肿瘤作用。化合物Ⅴ也可通过下图所示方法合成:


回答下列问题:
(1)化合物Ⅲ的分子式为 ,1 mol该物质完全燃烧需消耗 mol O2。
(2)化合物Ⅱ的合成方法为:
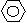
|

 -CH=CHCOOH 化合物Ⅱ,合成肉桂酸的反应式中,反应物的物质的量之比为1︰1。反应物A的结构简式是 。
-CH=CHCOOH 化合物Ⅱ,合成肉桂酸的反应式中,反应物的物质的量之比为1︰1。反应物A的结构简式是 。
(3)反应①的反应类型为 。化合物Ⅰ和Ⅱ反应还可以得到一种酯,生成该酯的反应方程式为 。(不用注明反应条件)
(4)下列关于化合物Ⅳ、Ⅴ的说法正确的是 (填序号)。
a.都属于芳香化合物
b.都能与H2发生加成反应,Ⅳ消耗的H2更多
c.都能使酸性KMnO4溶液褪色
d.都能与FeCl3溶液发生显色反应
(5)满足以下条件的化合物Ⅰ的同分异构体Ⅵ的结构简式为
①遇FeCl3溶液显示特征颜色
②l mol Ⅵ与浓溴水反应,最多消耗1 mol Br2
③Ⅵ的核磁共振氢谱有五组峰,峰面积之比为1︰1︰2︰2︰6
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质性质的应用正确的是
A.有机磷农药多为磷酸酯或硫代磷酸酯类物质,肥皂水等碱性物质有利其水解而解毒
B.二氧化硅是制造太阳能电池板的主要材料
C.二氧化硫通入酸性KMnO4溶液,溶液紫红色褪去,体现了SO2的漂白性
D.常温下浓H2SO4和浓HNO3都能使Cu发生钝化
查看答案和解析>>
科目:高中化学 来源: 题型:
 某温度下,向一定体积0.10mol•L—1醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH[pOH=—lg(OH—)] 与pH的变化关系如图所示,则
某温度下,向一定体积0.10mol•L—1醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH[pOH=—lg(OH—)] 与pH的变化关系如图所示,则
A.在反应过程中P点水的电离程度最大
B.M点和Q点溶液导电能力相同
C.反应过程中一定存在:
0.1mol·L—1+c(OH—)=c(Na+)+c(H+)+c(CH3COOH)
D.Q点对应的溶质可能有三种可能:
①CH3COONa ②CH3COONa、CH3COOH ③CH3COONa、NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
自然界中存在大量的金属元素,其中钠、镁、铁、铜等在工农业生产中有着广泛的应用。
(1)合成氨是人类科学技术上的一项重大突破,工业合成氨生产中常用铁触媒作催化剂。请写出Fe元素的基态原子核外电子排布式 。
(2)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(I)溶液来吸收原料气体中的CO(Ac— = CH3COO—),其反应是:
[Cu(NH3)2] Ac +CO+NH3  [Cu(NH3)3]Ac·CO[醋酸羰基三氨合铜(I)] △H<0
[Cu(NH3)3]Ac·CO[醋酸羰基三氨合铜(I)] △H<0
①C、N、O三种元素的第一电离能由小到大的顺序为 。
②[Cu(NH3)2]+中存在的化学键类型有 (填序号)。
A.配位键 B.离子键 C.极性共价键 D.非极性共价键
③氨分子中N原子的杂化方式为 。
 (3)NaCl和MgO都属离子化合物,NaCl的熔点为801.3℃, MgO的熔
(3)NaCl和MgO都属离子化合物,NaCl的熔点为801.3℃, MgO的熔
点高达2800℃。造成两种晶体熔点差距的主要原因是 。
(4)铜的化合物种类也很多,其常见价态为+1、+2价。如CuO、Cu2O、
CuH等。右图是铜的一种氯化物晶体的晶胞结构,则它的化学式是
。
查看答案和解析>>
科目:高中化学 来源: 题型:
在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液生成沉淀的量与滴入NaOH溶液的体积关系如图所示则原混合溶液中Al2(S04)3与MgSO4的物质的量浓度之比为

A.6:1 B.3:1 C.2:1 D.1:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com