
【题目】实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),过程如下:
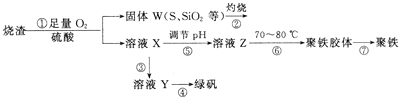
(1)将过程②中产生的气体通入下列溶液中,溶液不会褪色的是_____(填标号)。
A.品红溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.溴水
(2)过程①中,FeS和O2、H2SO4反应的离子方程式为_________。
(3)过程③中,需加入的物质是__________。
(4)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取2. 800 g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为3. 495 g。若该聚铁主要成分为[Fe(OH) (SO4)]n,则该聚铁样品中铁元素的质量分数为____________(假设杂质中不含铁元素和硫元素)。
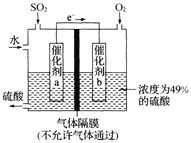
(5)如图是将过程②产生的气体SO2转化为重要的化工原料H2SO4的原理示意图,若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为______。
【答案】B 4 FeS+3O2+12 H+=== 4Fe3++6H2O+4S Fe(或铁) 30% 8 : 15
【解析】
过程②产生的气体为![]() ,具有还原性和漂白性;根据反应物和生成物的种类结合质量守恒书写化学方程式;溶液X中含有
,具有还原性和漂白性;根据反应物和生成物的种类结合质量守恒书写化学方程式;溶液X中含有![]() ,要制备绿矾,应加入
,要制备绿矾,应加入![]() 使之还原为
使之还原为![]() ;
;
(1)过程②产生的气体为![]() ,具有还原性和漂白性,因具有漂白性而使品红褪色,因具有还原性而使具有氧化性的酸性
,具有还原性和漂白性,因具有漂白性而使品红褪色,因具有还原性而使具有氧化性的酸性![]() 溶液、溴水褪色,只有紫色石蕊试液不会褪色。
溶液、溴水褪色,只有紫色石蕊试液不会褪色。
故答案为:B;
(2)反应物为![]() 、
、![]() 和
和![]() ,生成物有
,生成物有![]() ,根据质量守恒还应有
,根据质量守恒还应有![]() 和
和![]() ,反应的离子方程式为
,反应的离子方程式为![]() ,
,
故答案为:![]() ;
;
(3)溶液X中含有![]() ,要制备绿矾,应加入
,要制备绿矾,应加入![]() 使之还原为
使之还原为![]() ,加入铁可生成
,加入铁可生成![]() ,并且不引入新的杂质,
,并且不引入新的杂质,
故答案为:Fe(或铁);
(4)过滤、洗涤、干燥,称量,得固体质量为3.495g,应为BaSO4沉淀,![]() ,则
,则![]() ,
,![]() ,该聚铁样品中铁元素的质量分数
,该聚铁样品中铁元素的质量分数![]() ,
,
故答案为:30%
(5)原硫酸浓度为49%,得到的硫酸浓度仍为49%,所以新生成的硫酸的质量比后加入物质的总质量为49%,总方程式为:![]() ,加入
,加入![]() 的质量为x g,加入水的质量为y g,需要通入氧气的质量为:
的质量为x g,加入水的质量为y g,需要通入氧气的质量为:![]() g,新生成硫酸的质量为
g,新生成硫酸的质量为![]() g,故
g,故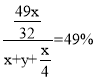 ,解得
,解得![]() ,
,
故答案为:8 : 15。


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】K2 FeO4在水中不稳定,发生反应:![]() +l0H2O
+l0H2O![]() 4Fe(OH)3(胶体)+8OH-+3O2,其稳定性与温度(T)和溶液pH的关系分别如下图所示。下列说法不正确的是 ( )
4Fe(OH)3(胶体)+8OH-+3O2,其稳定性与温度(T)和溶液pH的关系分别如下图所示。下列说法不正确的是 ( )
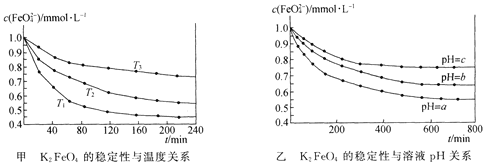
A.由图甲可知上述反应 △H < 0
B.由图甲可知温度:T1 > T2 > T3
C.由图甲可知K2 FeO4的稳定性随温度的升高而减弱
D.由图乙可知图中a < c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E五种短周期元素,已知A、B、C、D四种元素的核内质子数之和为56,在元素周期表中的位置如图所示,1 mol E的单质可与足量酸反应,能产生33.6 L H2(在标准状况下);E的阳离子与A的阴离子核外电子层结构相同。
A | ||
B | C | D |
回答下列问题:
(1)写出下列元素名称A__________,B___________,E____________
(2)C的简单离子结构示意图为_____________
(3)B单质在A单质中燃烧,反应现象是__________________________________,生成物的化学式为___________
(4)A与E形成的化合物的化学式为__________,它的性质决定了它在物质的分类中应属于__________________
(5)向D与E形成的化合物的水溶液中滴入烧碱溶液至过量,此过程中观察到的现象是_______________________,写出有关化学反应方程式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是
A.一定条件下,合成氨反应中有0.5molN2发生反应,则反应中转移电子数为3NA
B.10克环己烷与2-丙醇的混合液中,碳元素的质量分数为72%,则其中所含的氧原子数目为![]() NA
NA
C.12g石墨中含有3NA个C-C共价键
D.常温常压下有28g单晶硅晶体,则其中所含的Si﹣Si键数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月18日中国地质调查局宣布,我国在南海进行的可燃冰试采获得成功,成为全球第一个获得可燃冰连续稳定产气的国家。可燃冰是天然气与水相互作用形成的晶体物质,主要存在于冻土层和海底大陆架中。下列说法正确的是( )

①甲烷属于烃类;②相同条件下,甲烷的密度大于空气的密度;③甲烷难溶于水;④可燃冰是一种极具潜力的能源;⑤青藏高原可能存在巨大体积的“可燃冰”
A.①③④⑤B.②③④⑤C.①②③⑤D.①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是一种检验某气体化学性质的实验装置,图中B为开关。 如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条颜色褪去。则D瓶中盛有的溶液是( )
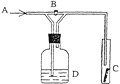
A.浓H2SO4 B.饱和食盐水C.浓NaOH溶液D.KI溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子反应方程式正确的是
A.向NaAlO2溶液中通入过量CO2制Al(OH)3:2![]() +CO2+3H2O=2Al(OH)3↓+
+CO2+3H2O=2Al(OH)3↓+![]()
B.用硫酸酸化的淀粉碘化钾溶液在空气中变蓝:4I-+O2+4H+=2I2+2H2O
C.漂白粉溶液通入少量SO2:Ca2++2ClO-+SO2+H2O=2HClO+CaSO3↓
D.Na2O2溶于水产生O2:Na2O2+H2O=2Na++2OH-+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(227℃,1个大气压时),1.5L某烃蒸汽能在aL氧气中完全燃烧,体积增大到(a+3)L(相同条件下),问:
(1)该烃在组成上必须满足的基本条件是____________________
(2)当a=10L时,该烃可能的分子式__________________
(3)当该烃的分子式为C7H8时,a的取值范围为____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组用凯氏定氮法(Kjeldahl method)来测定农产品中氮的含量,测定过程如下:
I.用热浓硫酸处理0.25g谷物样品,把有机氮转化为铵盐。
II.用下图所示装置处理上述铵盐(夹持装置略去)。
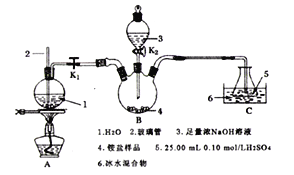
回答下列问题:
(1)实验前要检验B装置的气密性,具体操作为______________________________。
(2)盛放氢氧化钠溶液的仪器名称为__________________;玻璃管2的作用是___________________;圆底烧瓶中碎瓷片的作用是_________________________________________。
(3)将“谷物处理后所得的铵盐”加入三颈瓶中,打开玻璃塞、旋开K2,加入足量氢氧化钠溶液,关闭K2,打开K1,点燃酒精灯使水蒸气进入B装置。
①B装置中反应的离子方程式为_______________________________。
②C装置冰水混合物的作用是__________________________________。
III.滴定、计算氮的含量
(4)取下锥形瓶,加入指示剂,用0.10mol/L的NaOH溶液滴定,重复滴定3次,平均消耗19.30mLNaOH溶液。
①该滴定的指示剂应选择____________________。
a.甲基橙 b.配酞 c.甲基橙或酚酞
②该谷物样品中氮的百分含量为_____________。(保留2位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com