
【题目】A、B、C、D、E代表前四周期原子序数依次增大的五种元素。A、D同主族且有两种常见化合物DA2和DA3;工业上电解熔融C2A3制取单质C, B、E除最外层均只有2个电子外,其余各层全充满,E位于元素周期表的ds区。回答下列问题:
(l) B、C中第一电离能较大的是_________,基态D原子价电子的轨道表达式为_______
(2) DA2分子的VSEPR模型是________。H3A比H2D熔沸点高得多的原因是_________。
(3)实验测得C与氯元素形成化合物的实际组成为C2Cl6,其球棍模型如图所示。已知C2Cl6在加热时易升华,与过量的NaOH 溶液反应可生成Na[C(OH)4]

①C2Cl6属于_________晶体(填晶体类型),其中C原子的杂化轨道类型为______杂化。
②[C(OH)4]-中存在的化学健有__________。
(4)工业上制备B的单质是电解熔融B的氯化物,而不是电解BA,原因是_________。
(5)B、C的氯化物晶格能分别是2957KJ/mol、5492KJ/mol,二者相差很大的原因是________。
(6)D与E所形成化合物晶体的晶胞如右图所示。

①在该晶胞中,E的配位数为__________。
②原子坐标参数可表示晶胞内部各原子的相对位置。右图晶胞中,原子坐标参数a为(0,0,0);b为(1/2,0,1/2),c为(1/2,1/2,0).则d原子的坐标为__________。
③已知该晶胞的密度为ρg/cm3,则其中两个D,原子之间的距离为____pm(列出计算式即可)。
【答案】(1)镁(或Mg);![]() ;
;
(2)平面三角形;H2O分子间存在氢键;
(3)①分子;sp3;②极性共价键、配位键(或共价键、配位键);
(4)熔融MgCl2能导电,可电解;MgO熔沸点高,电解熔融MgO能耗大;
(5)Al3+比Mg2+电荷高、半径小,AlF3的晶格能比MgCl2大得多;
(6)① 4; ②(0,![]() ,
,![]() ); ③
); ③![]() ×
×![]() ×1010;
×1010;
【解析】试题分析:A、B、C、D、E代表前四周期原子序数依次增大的五种元素。A、D同主族且有两种常见化合物DA2和DA3,则A为O元素,D为S元素;工业上电解熔融C2A3制取单质C,则C为Al元素;B、E除最外层均只有2个电子外,其余各层全充满,E位于元素周期表的ds区,则B为Mg元素,E为Zn元素。
(1)镁原子的3s为全充满状态,较为稳定,第一电离能较大;D为S元素;基态D原子价电子的轨道表达式为![]() ,故答案为:镁(或Mg);
,故答案为:镁(或Mg);![]() ;
;
(2)SO2分子的价层电子对数=2+![]() (6-2×2)=3,VSEPR模型是平面三角形。H2O分子间能够形成氢键,熔沸点比硫化氢高,故答案为:平面三角形;H2O分子间存在氢键;
(6-2×2)=3,VSEPR模型是平面三角形。H2O分子间能够形成氢键,熔沸点比硫化氢高,故答案为:平面三角形;H2O分子间存在氢键;
(3)① Al2Cl6加热时易升华,属于分子晶体,根据结构示意图,其中Al 原子采用sp3杂化,故答案为:分子;sp3;
② [Al (OH)4]-中存在的化学键有共价键、配位键,故答案为:共价键、配位键;
(4)工业上电解熔融氯化镁制备镁,而不是电解氧化镁,是因为熔融MgCl2能导电,可电解;MgO熔沸点高,电解熔融MgO能耗大,故答案为:熔融MgCl2能导电,可电解;MgO熔沸点高,电解熔融MgO能耗大;
(5)Al3+比Mg2+电荷高、半径小,AlF3的晶格能比MgCl2大得多,故答案为:Al3+比Mg2+电荷高、半径小,AlF3的晶格能比MgCl2大得多;
(6)① 根据晶胞结构可知,在晶体中,与E距离最小,且相等的D原子数为4,因此配位数为4,故答案为:4;
②D与周围4个原子形成正四面体结构,D位于a原子右边与x轴垂直的面心上,与b原子等高,与c原子在的连线在垂直与y轴的平面上,则D原子的坐标参数为(1,![]() ,
,![]() );故答案为:(1,
);故答案为:(1,![]() ,
,![]() );
);
③该晶胞中Zn原子数=8×![]() +6×
+6×![]() =4,O原子数=4,设晶胞的晶胞参数为acm,则ρ g/cm3=
=4,O原子数=4,设晶胞的晶胞参数为acm,则ρ g/cm3=![]() =
=![]() g/cm3,解得a=
g/cm3,解得a=![]() ,晶胞面对角线长度为
,晶胞面对角线长度为![]() a cm=
a cm=![]() ×
×![]() cm,故晶胞中D和D离子的距离为对角线长度的一半,为
cm,故晶胞中D和D离子的距离为对角线长度的一半,为![]() ×
×![]() cm=
cm=![]() ×
×![]() ×1010pm,故答案为:
×1010pm,故答案为:![]() ×
×![]() ×1010。
×1010。


科目:高中化学 来源: 题型:
【题目】在200mL某硫酸盐溶液中,含有1.5NA个硫酸根离子(NA表示阿伏加德罗常数的值),同时含有NA个金属离子.则该硫酸盐的物质的量浓度为
A.2 molL﹣1 B.7.5 molL﹣1 C.5 molL﹣1 D.2.5 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸钴[ Cox(OH)y(CO3)2 ]常用作电子材料,磁性材料的添加剂,受热时可分解生成三种氧化物。为了确定其组成,某化学兴趣小组同学设计了如图所示进行实验。
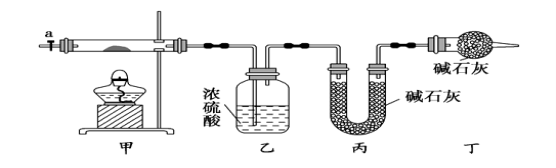
⑴请完成下列实验步骤:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,并检验装置气密性;
③加热甲中玻璃管,当乙装置中___________(填实验现象),停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算。
⑵步骤④中缓缓通入空气数分钟的目的是__________________。
⑶某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用下列装置中的_____ _(填字母)连接在_____ ____(填装置连接位置)。

⑷若按正确装置进行实验,测得如下数据:
乙装置的质量/g | 丙装置的质量/g | |
加热前 | 80.00 | 62.00 |
加热后 | 80.36 | 62.88 |
则该碱式碳酸钴的化学式为____________________。
⑸CoCl2·6H2O常用作多彩水泥的添加剂,以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种工艺如下:

已知:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
开始沉淀(PH) | 2.3 | 7.5 | 7.6 | 3.4 |
完全沉淀(PH) | 4.1 | 9.7 | 9.2 | 5.2 |
①净除杂质时,加入H2O2 发生反应的离子方程式为______________________。
②加入CoCO3调PH为5.2~7.6,则操作Ⅰ获得的滤渣成分为__________________。
③加盐酸调整PH为2~3的目的为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年3月28 日,中国成功开采可燃冰,主要成分为甲烷,属于一次能源。下列不属于 一次能源的是( )
A. 石油 B. 风能 C. 太阳能 D. 氢能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化规律的叙述中,正确的是( )
A.F﹣、Cl﹣、Br﹣、I﹣的还原性逐渐减弱
B.NaOH、KOH、RbOH的碱性逐渐减弱
C.Li、Na、K、Rb、Cs的金属性逐渐减弱
D.HF、HCl、HBr、HI的稳定性逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 可以利用溴水区分裂化汽油和直馏汽油
B. 煤的气化是指高温下煤与水蒸汽反应生成CO、CH4、H2、焦炉气的过程
C. 乙烯、苯均能与H2发生加成反应,说明二者均含碳碳双键
D. 相同质量的乙炔、苯分别在足量的氧气中燃烧,苯比乙炔消耗的氧气质量多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制100 mL 0.1 mol·L-1Na2CO3溶液,下列操作正确的是( )
A. 称取1.06 g无水碳酸钠,加入到100 mL的容量瓶中,加水溶解、定容
B. 称取1.06 g无水碳酸钠,加入100 mL蒸馏水,搅拌、溶解
C. 转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中
D. 定容后,塞好瓶塞,反复倒转,摇匀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com