
| A. | ①③⑤ | B. | ②④⑥ | C. | ①④⑥ | D. | ③⑤⑥ |
分析 ①原子间的强烈的相互作用叫化学键;
②两个非金属原子间通过共用电子对形成相互作用;
③强电解质中不一定存在离子键;
④断键吸收能量,成键放出能量;
⑤单质中可能不存在化学键;
⑥非金属元素也可能形成离子化合物.
解答 解:①原子间的强烈的相互作用叫化学键,相互作用力包含吸引力和排斥力,故错误;
②两个非金属原子间通过共用电子对形成相互作用,所以两个非金属元素原子间只能形成共价键,不可能形成离子键,故正确;
③强电解质中不一定存在离子键,如HCl、硫酸等强电解质中只含有共价键,故错误;
④断键吸收能量,成键放出能量,所以形成化学键的过程是能量降低的过程,故正确;
⑤单质中可能不存在化学键,如稀有气体中不存在化学键,故错误;
⑥非金属元素也可能形成离子化合物,如氯化铵属于离子化合物,只含有非金属元素,故正确.
故选B.
点评 本题考查了化学键的概念、强弱电解质的判断等知识点,根据物质的构成微粒确定化学键类型,强弱电解质与其电离程度有关,与存在的化学键无关,为易错点.


科目:高中化学 来源: 题型:解答题
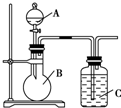 某同学设计如图装置,研究非金属元素性质变化规律.
某同学设计如图装置,研究非金属元素性质变化规律.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
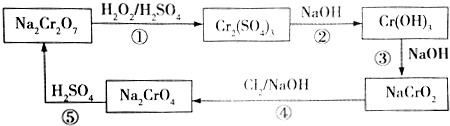
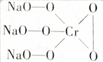 ,则Cr的化合价为+5,其中含有的化学键有离子键、共价键.
,则Cr的化合价为+5,其中含有的化学键有离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有离子键的化合物必是离子化合物 | |
| B. | 含有共价键的化合物就是共价化合物 | |
| C. | 共价化合物可能含离子键 | |
| D. | 离子化合物中一定含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体不均一、不稳定,静置后易产生沉淀;溶液均一、稳定,静置后不产生沉淀 | |
| B. | 一种透明液体中加入电解质溶液,若有沉淀生成,则该液体不一定是胶体 | |
| C. | 光线通过时,胶体产生丁达尔效应,溶液则无丁达尔效应 | |
| D. | 放电影时,放映室射到银幕上的光柱是由胶粒对光的散射形成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
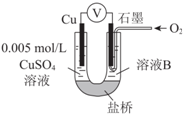 某小组同学利用原电池装置探究物质的性质.
某小组同学利用原电池装置探究物质的性质.| 装置 | 编号 | 电极A | 溶液B | 操作及现象 |
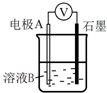 | Ⅰ | Fe | pH=2的 H2SO4 | 连接装置后,石墨表面产生无色气泡;电压表指针偏转 |
| Ⅱ | Cu | pH=2的H2SO4 | 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a |
| 编号 | 溶液B | 操作及现象 |
| Ⅲ | 经煮沸的pH=2的 H2SO4 | 溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b |
| Ⅳ | pH=2的H2SO4 | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c |
| Ⅴ | pH=12的NaOH | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com