
【题目】(1)三月万物复苏,很多人会外出踏青旅游。
①自驾游出行方便。制造汽车轮胎的主要材料是____(填字母)。
a.铝合金 b.橡胶 c.玻璃
②高速列车出行快捷。建设铁路需要大量水泥。工业上生产水泥的主要原料是石灰石和____(填字母)。
a.黏土 b.纯碱 c.石英
③轮船出行舒适。为防止轮船钢板被腐蚀,可在钢板上镶嵌____(填字母)。
a.铜块 b.锡块 c.锌块
(2)旅游期间,在娱乐、购物、旅游时要讲究文明、保护环境。
①用过的聚乙烯塑料食品袋要投入贴有可回收物标志的垃圾箱中。聚乙烯的结构简式是____。
②不法商贩会用由铜锌合金打造的假金首饰欺骗消费者。请写出检验金首饰真假的化学方法和结论____。
③不能携带烟花爆竹乘坐公共交通工具。制作烟花爆竹的黑火药是用木炭、硝酸钾、硫磺配制,黑火药爆炸时会生成氮气、硫化钾和二氧化碳。写出该反应的化学方程式____。
(3)在外出行要注意饮食健康。
①面包、牛奶是常见的食物之一,面包对人体的主要作用是____。牛奶中的蛋白质在人体内水解可生成____。
②为保证营养均衡,应摄入适量蔬菜。蔬菜中的膳食纤维对人体的作用是____。
③橙汁是常用饮品。某品牌橙汁中含有维生素C、白砂糖、精制盐、柠檬黄和苯甲酸钠等成分,这几种物质中属于着色剂的是____。缺少维生素C可能会引发的疾病是____。
④饮食不当会引起胃痛。胃舒平[主要成分是Al(OH)3]可治疗胃酸过多,写出Al(OH)3与胃酸反应的离子方程式____。
【答案】b a c ![]() 将首饰投入盛有盐酸的烧杯中,若有气泡生成(或灼烧表面变黑或与硝酸反应有气体等),证明是假金首饰 3C+S+2KNO3===3CO2↑+K2S+N2↑ 提供能量 氨基酸 促进消化 柠檬黄 坏血病 Al(OH)3+3H+===Al3++3H2O
将首饰投入盛有盐酸的烧杯中,若有气泡生成(或灼烧表面变黑或与硝酸反应有气体等),证明是假金首饰 3C+S+2KNO3===3CO2↑+K2S+N2↑ 提供能量 氨基酸 促进消化 柠檬黄 坏血病 Al(OH)3+3H+===Al3++3H2O
【解析】
(1)①飞机轮胎应有弹性;
②生产水泥的主要原料是黏土、石灰石;
③原电池中活泼金属做负极;
(2)①聚乙烯是乙烯通过加聚反应生成的,它属于高分子材料;
②锌能与酸反应生成氢气,金不能与酸反应;
③根据木炭、硫磺、硝石反应后生成硫化钾、氮气和二氧化碳进行分析;
(3)①人体的主要供能物质是糖类;蛋白质是构成人体细胞的基本物质,水解生成氨基酸;
②蔬菜中的膳食纤维对人体的作用是促进消化;
③柠檬黄是着色剂;缺少维生素C可能会引发的疾病是坏血病;
④Al(OH)3与胃酸反应生成氯化铝和水。
(1)①飞机轮胎应有弹性,合金和玻璃无弹性,故答案为:b;
②生产水泥的主要原料是黏土、石灰石,故答案为:a;
③原电池中活泼金属做负极,腐蚀锌,保护了铁,故答案为:c;
(2)①聚乙烯是乙烯通过加聚反应生成的,则聚乙烯的结构简式为:,聚乙烯为高分子化合物![]() ;
;
②锌能与酸反应生成氢气,金不能与酸反应,所以将首饰投入盛有盐酸的烧杯中,若有气泡生成,证明是假金首饰;
故答案为:将首饰投入盛有盐酸的烧杯中,若有气泡生成(或灼烧表面变黑或与硝酸反应有气体等),证明是假金首饰;
③木炭、硫磺、硝石在点燃的条件下生成硫化钾、氮气和二氧化碳,故答案为:3C+S+2KNO3=3CO2↑+K2S+N2↑;
(3)淀粉的消化从口腔开始,口腔中的唾液淀粉酶能够将部分淀粉分解为麦芽糖,当淀粉和麦芽糖进入小肠后,由于小肠中的胰液和肠液中含有消化糖类、脂肪和蛋白质的酶,因此,淀粉等糖类物质在小肠内被彻底消化为葡萄糖;其主要作用是为人体提供能量;
蛋白质是构成人体细胞的基本物质,人体的生长发育、组织的更新等都离不开蛋白质,蛋白质水解最终产物为氨基酸;
②蔬菜中的膳食纤维对人体的作用是促进消化;
③维生素C、白砂糖、精制盐、柠檬黄和苯甲酸钠等成分,这几种物质中属于着色剂的是柠檬黄;缺少维生素C可能会引发的疾病是坏血病;
④Al(OH)3与胃酸反应生成氯化铝和水,反应的离子方程式为Al(OH)3+3H+=Al3++3H2O。


科目:高中化学 来源: 题型:
【题目】摩尔盐[(NH4)2Fe(SO4)2·6H2O]是一种重要的化工原料,用途广泛。几位同学进行了如下实验以检验摩尔盐溶液中的NH4+、Fe2+、SO42-。
完成下列填空:
(1)甲同学向试样溶液中加入足量的Ba(OH)2溶液,微热,逸出可使_______试纸变蓝的气体以检验NH4+离子,同时生成白色沉淀,随即沉淀变为灰绿色,最后带有_________色,用足量_______溶液处理沉淀物,沉淀部分溶解以检验Fe2+、SO42-;
(2)乙同学提出检验Fe2+的方法:先向试样溶液中滴加KSCN,溶液呈无色,再加___________试剂,溶液呈血红色则有Fe2+。但实际操作中,乙同学向试样溶液中加入KSCN后,发现溶液变成浅红色,原因是________________;
丙同学欲测定某摩尔盐样品中Fe2+的含量。他称取0.400g该样品,溶于水,加入适量稀硫酸后,用0.0200mol/L的KMnO4溶液滴定,消耗KMnO4溶液10.00mL。
反应的离子方程式为:5Fe2++MnO4-+8H+→Mn2++5Fe3++4H2O。
(3)滴定终点的现象是_______________________,样品中Fe2+的百分含量是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Ca(OH)2、NaAlO2、NaOH配成100.0mL混合溶液,向该溶液中通入足量CO2,生成沉淀的物质的量n(沉淀),与通入CO2的体积(标准状况下)V(CO2)的关系,如图所示,下列说法中正确的是( )
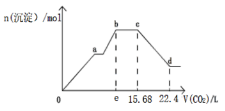
A. 混合溶液中c(NaOH)+c(NaAlO2)=0.4mol/L
B. e点的值为11.2
C. cd段表示Al(OH)3沉淀溶解
D. bc段的化学反应方程式为:NaOH+CO2=NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有一包白色固体,可能含有NaCl、NaHCO3和NH4Cl中的一种或多种。下列根据实验事实得出的结论正确的是
A. 取一定量固体,在空气中充分加热,有白色物质残留,则原白色固体中含NaCl
B. 取一定量固体,加水溶解,向溶液中加入少量NaOH溶液,再滴加AgNO3溶液,有白色沉淀生成,则该白色沉淀是AgCl
C. 取一定量固体,加水溶解,向溶液中滴加足量NaOH溶液,加热,将得到气体直接通入足量浓硫酸,浓硫酸增重3.40 g,则原白色固体中含NH4Cl 10.7 g
D. 取一定量固体,加水溶解,向溶液中滴加足量Ba(OH)2溶液,有白色沉淀生成,将沉淀过滤、洗涤、干燥,得到沉淀质量为3.94 g,则原白色固体中含NaHCO3 1.68 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双极膜(BP)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-,作为H+和OH-离子源。利用双极膜电渗析法电解食盐水可获得淡水、NaOH和HC1,其工作原理如下图所示,M、N为离子交换膜。
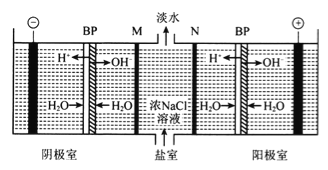
下列说法错误的是
A. 阴极室发生的反应为2H++2e-=H2↑
B. M为阳离子交换膜,N为阴离子交换膜
C. 若去掉双极膜(BP),阳极室会有C12生成
D. 电路中每转移1mol电子,两极共得到0.5 mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol/L NaOH溶液分别滴定20. 00 mL 0.1000 mol/L 盐酸和20. 00 mL 0.1000 mol/L 醋酸溶液,得到2条滴定曲线,如下图所示。
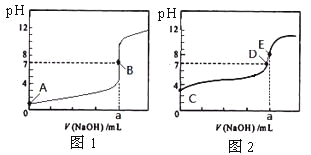
若以HA表示酸,下列说法正确的是
A. 滴定盐酸的曲线是图2
B. 达到B、D状态时,两溶液中离子浓度均为c(Na+)=C(A-)
C. 达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl)
D. 当0 mL<V(NaOH) <20. 00 mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(A—) >c(Na+)>c(H+) >c(OH—)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验是化学研究的一种重要手段,现有图所示A-G七种仪器,请根据要求填空。

(I)写出仪器名称:F_________。
(II)下列实验操作中用到仪器G的是_______(选填下列选项的编号字母)。
a.分离水和CC14的混合物b.分离水和酒精的混合物c.分离水和泥砂的混合物
(III)配制480mL、0.2molL-1CuSO4溶液。
(1)应用托盘天平称取CuSO45H2O晶体____________,
(2)使用容量瓶前必须进行的一步操作是________,在容量瓶上需标记的是____________(填字母),
a.温度b.刻度线c.浓度d.容积
(3)所需仪器除了烧杯、玻璃棒、托盘天平外,还缺少__________________,
(4)实验中两次用到玻璃棒,起作用分别是____________、____________。
(5)配制溶液时除了称量、溶解、冷却、转移溶液、摇匀操作外,还缺少:__________________(填操作名称)。
(6)若实验中有下列情况,对配制溶液的浓度有何影响?(填“偏高”、“偏低”或“无影响”)
a.胆矾失去了部分结晶水____________;
b.定容时加水超过刻度线____________;
c.最终定容时仰视观察液面____________;
d.容量瓶不干燥,含有少量蒸馏水____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Cl2生产某些含氯有机物时会生成副产物HCl,利用下列反应可实现氯的循环利用:4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g) ΔH=-115.6 kJ·mol-1。恒温恒容的密闭容器中,充入一定量的反应物发生上述反应,能充分说明该反应达到化学平衡状态的是( )
2Cl2(g)+2H2O(g) ΔH=-115.6 kJ·mol-1。恒温恒容的密闭容器中,充入一定量的反应物发生上述反应,能充分说明该反应达到化学平衡状态的是( )
A. 混合气体的密度不再改变
B. 氯化氢的转化率不再改变
C. 断开4 mol H—Cl键的同时生成4 mol H—O键
D. n(HCl)∶n(O2)∶n(Cl2)∶n(H2O)=4∶1∶2∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,在体积为VL的固定容积的容器中发生反应:A(g)+B(g)![]() 3C(g)(正反应为放热反应)下列说法能说明该反应已经达到平衡状态的是( )
3C(g)(正反应为放热反应)下列说法能说明该反应已经达到平衡状态的是( )
①单位时间内生成C的分子数与分解C的分子数相等②外界条件不变时,ABC的浓度不随时间变化③体系温度不再变化④体系的分子总数不再变化 ⑤反应速率3v(B)=v(C)
A.①②B.①②③
C.①②③④D.①②③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com