
实验室以含有Ca2+、Mg2+、Cl-、SO42-、Br-等离子的卤水为主要原料制备无水CaCl2和Br2,流程如下:
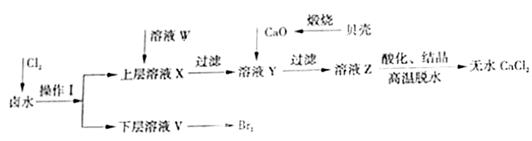
(1)操作Ⅰ使用的试剂是 ,所用主要仪器的名称是  。
。
(2)加入溶液W的目的是 。用CaO调节溶液Y的pH,可以除去Mg2+。由表中数据可知,理论上可选择pH最大范围是 。酸化溶液Z时,使用的试剂为 。
| 开始沉淀时的pH | 沉淀完全时的pH | |
| Mg2+ | 9.6 | 11.0 |
| Ca2+ | 12.2 | c(OH-)=1.8mol·L-1 |
(3)实验室用贝壳与稀盐酸反应制备并收集CO2气体,下列装置中合理的是 。

(4)常温下,H2SO3的电离常数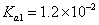 ,
,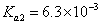 ,H2CO3的电
,H2CO3的电 离常数
离常数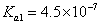 ,
,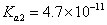 。某同学设计实验验证H2SO3酸性强于H2CO3:将SO2和CO2气体分别通入水中至饱和,立即用酸度计测两溶液的pH,若前者的pH小于后者,则H2SO3酸性强于H2CO3。该实验设计不正确,错误在于 。
。某同学设计实验验证H2SO3酸性强于H2CO3:将SO2和CO2气体分别通入水中至饱和,立即用酸度计测两溶液的pH,若前者的pH小于后者,则H2SO3酸性强于H2CO3。该实验设计不正确,错误在于 。
设计合理实验验证2SO3酸性强于H2CO3(简要说明实验步骤、现象和结论)。 。仪器器自选。
供选的试剂:CO2、SO2、Na2CO3、NaHCO3、KMnO4、NaHSO3、蒸馏水、饱和石灰水、酸性KMnO4 溶液、品红溶液、pH试纸。
【解析】本题主要考察常见的基本实验操作、仪器的使用、离子的除杂和实验方案设 计,综合性强。
计,综合性强。
(1)氯气具有强氧化性,通入氯气后可以将溶液中的Br-氧化溴单质,因为单质溴极易溶于有机溶剂,所以可以采用萃取的方法,萃取的主要仪器是分液漏斗。由流程图可知单质溴在下层,因此该有机溶剂的密度要比水的大且不溶于水,所以该试剂是CCl4;
(2)由于SO42-会与Ca2+结合形成微溶性的硫酸钙而影响氯化钙的制备,因此必需除去;由表中数据可知pH大于11时Mg2+沉淀完全,pH大于12.2时,Ca2+开始沉淀,所以理论上可选择pH最大范围是11.0≤pH<12.2;因为不能引入新的杂质,所以酸化溶液Z时,使用的试剂应该为盐酸。
(3)实验室制取CO2的特点是固体和液体反应且不需要加热,由于盐酸易挥发,因此在收集之前需要出去挥发出HCl气体,因为CO2的密度大于空气中的,所以采用向上排空气发收集CO2气体。若采用长颈漏斗时,长颈漏斗的下端必需插入到溶液中,以防止CO2气体从长颈漏斗中挥发出来,因此选项b、d正确。
(4)H2SO3和H2CO3均属于二元酸,要想通过比较二者的pH来验证二者的酸性强弱,必需使二者的浓度相同,但是SO2和CO2气体溶于水后的饱和溶液其浓度显然不相等(因为二者的溶解度不同),所以该实验设计不正确;要检验酸性强弱,可以采用多种方法,例如利用水解原理(酸越弱相应的强碱盐就越易水解),也可以利用较强的酸制取较弱的酸来检验。由于SO2和CO2气体均可以使饱和石灰水编混浊,所以CO2气体在通入饱和石灰水之前必需除去CO2气体中混有的SO2气体。
【答案】(1)四氯化碳;分液漏斗
(2)除去溶液中的SO42-;11.0≤pH<12.2;盐酸
(3)b、d
(4)用于比较pH的两种酸的物质的量浓度不相等;参考方案如下:
方案一:配制相同物质的量浓度的NaHSO3和NaHCO3溶液,用酸度计(或pH试纸)测两溶液的pH。前者的pH小于后者,证明H2SO3酸性强于H2CO3。
方案二:将SO2气体依次通过NaHCO3(Na2CO3)溶液、酸性KMnO4溶液、品红溶液、澄清石灰水。品红溶液不褪色、且澄清石灰水变混浊,证明H2SO3酸性强于H2CO3。
方案三:将CO2气体依次通过NaHSO3(Na2SO3)溶液、品红溶液。品红溶液不褪色,证明H2 SO3酸性强于H2CO3。
SO3酸性强于H2CO3。


科目:高中化学 来源: 题型:
研究性学习小组进行SO2的制备及性质探究实验。
⑴ 根据反应Na2SO3(固) + H2SO4(浓) == Na2SO4 + SO2↑+H2O,制备SO2气体。
用下列简图,在答题卡的方框中画出制备并收集SO2的实验装置(含试剂)示意图。
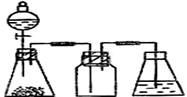
② 实验过程中,使用分液漏斗滴加浓硫酸的操作是__________________________。
⑵ 将SO2气体分别通入下列溶液中:
① 品红溶液,现象是__________________________________________________。
② 溴水溶液,现象是_________________________________________________。
③ 硫化钠溶液,现象是________________________________________________。
⑶ 有一小组在实验中发现,SO2氧化产生缓慢,以致后续实验现象很不明显,但又不存在气密性问题。请你推测可能的原因并说明相应的验证方法(可以不填满)
① 原因_______________________,验证方法________________________________。
② 原因_______________________,验证方法________________________________。
③ 原因_______________________,验证方法________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
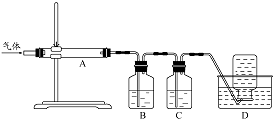 纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:

(1)MgCO3与稀硫酸反应的离子方程式为 。
(2)加入H2O2氧化时,发生反应的化学方程式为 。
(3)滤渣2的成分是 (填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用右图装置对煅烧产生的气体进行分步吸收或收集。
①D中收集的气体可以是 (填化学式)。
②B中盛放的溶液可以是 (填字母)。
a.NaOH 溶液 b.Na2CO3溶液 c.稀硝酸 d.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是
| 操作 | 现象 | 结论 | |
| A | 滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中有SO42- |
| B | 滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+,无K+ |
| D | 滴加稀NaOH溶液,将湿润红 | 试纸不变蓝 | 原溶液中无NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
二苯基乙二酮常用作医药中间体及紫外线固化剂,可由二苯基羟乙酮氧化制得,反应的化学方程式及装置图(部分装置省略)如下:
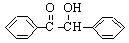 +2FeCl3
+2FeCl3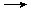
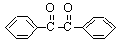 +2FeCl2+2HCl
+2FeCl2+2HCl
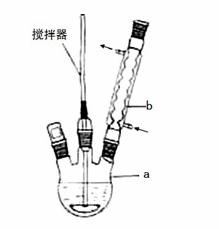
在反应装置中,加入原料及溶剂,搅拌下加热回流。反应结束后加热煮沸,冷却后即有二苯基乙二酮粗产品析出,用70%乙醇水溶液重结晶提纯。重结晶过程:
加热溶解→活性炭脱色→趁热过滤→冷却结晶→抽滤→洗涤→干燥
请回答下列问题:
(1)写出装置图中玻璃仪器的名称:a___________,b____________。
(2)趁热过滤后,滤液冷却结晶。一般情况下,下列哪些因素有利于得到较大的晶体:____。
A.缓慢冷却溶液 B.溶液浓度较高
C.溶质溶解度较小 D.缓慢蒸发溶剂
如果溶液中发生过饱和现象,可采用__________等方法促进晶体析出。
(3)抽滤所用的滤纸应略_______(填“大于”或“小于”)布氏漏斗内径,将全部小孔盖住。烧杯中的二苯基乙二酮晶体转入布氏漏斗时,杯壁上往往还粘有少量晶体,需选用液体将杯壁上的晶体冲洗下来后转入布氏漏斗,下列液体最合适的是________。
A.无水乙醇 B.饱和NaCl溶液 C.70%乙醇水溶液 D.滤液
(4)上述重结晶过程中的哪一步操作除去了不溶性杂质:___________。
(5)某同学采用薄层色谱(原理和操作与纸层析类同)跟踪反应进程,分别在反应开始、回流15min、30min、45min和60min时,用毛细管取样、点样、薄层色谱展开后的斑点如图所示。该实验条件下比较合适的回流时间是________。
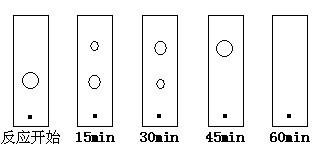
A.15min B.30min C.45min D.60min
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物A由周期不同的短周期元素X、Y组成,是良好的耐热冲击材料。
(1)X的单质既可与盐酸反应,又可与NaOH溶液反应。X的原子结构示意图为________。
(2)X的硫酸盐溶液与过量NaOH溶液反应的离子方程式为__________________________。
(3)一定条件下,A和水缓慢作用生成含Y的化合物Z,Z分子含有10个电子。
①Z与H2O2反应,其产物之一是Y的单质,Y单质的电子式为____________;Z分子的结构呈____________。
②A的化学式是________________________。
(4)X的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料(在火箭和导弹上有重要应用),其反应的化学方程式是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.稀硝酸、稀硫酸均能将木炭氧化成二氧化碳
B.Na2O2与水反应、红热的Fe与水蒸气反应均能生成碱
C.Li、C、P分别在足量氧气中燃烧均生成一种相应氧化物
D.NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.我国流通的硬币材质是金属单质
B.所有的不锈钢都只含有金属元素
C.广东正在打捞的明代沉船上存在大量铝制餐具
D.镁合金的硬度和强度均高于纯镁
查看答案和解析>>
科目:高中化学 来源: 题型:
19世纪末,中国开始兴办近代钢铁工业,经过百余年艰苦曲折的发展历程,中国钢产量在20世纪末突破一亿吨,居世界第一位。
42.(1)生铁是通过高炉冶炼而得,冶炼过程中一氧化碳还原赤铁矿的化学方程式为 。
(2)铁在一定条件下可与多种非金属单质反应,铁与氯气反应的化学方程式为 ,铁与硫反应的化学方程式为 。
43.今有一铁屑和铝屑的混合物110g ,其中铝屑的质量分数为49%,试计算该混合物与适量稀硫酸反应能释放出多少升氢气(标准状况)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com