


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
| A、Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性 |
| B、能使湿润的淀粉KI试纸变成蓝色的物质一定是Cl2 |
| C、SiO2与酸、碱均不反应 |
| D、分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除硫酸厂尾气:SO2+2NH3+H2O═(NH4)2SO3 | ||||
| B、消除硝酸工业尾气氮氧化物的污染:2NaOH+NO2+NO═2NaNO2+H2O | ||||
C、制备CuSO4:Cu+2H2SO4(浓)
| ||||
D、制备CuSO4:2Cu+O2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
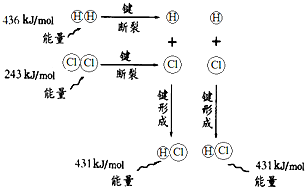
| A、H2(g)和Cl2(g)反应生成HCl(g)是吸热反应 |
| B、2个H原子结合生成一个H2分子时放出436kJ能量 |
| C、1molHCl(g)分子中的化学键断裂时需要吸收862kJ能量 |
| D、H2(g)+Cl2(g)═2HCl(g)的反应热△H=-183kJ?mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com