
下列关于第IVA族元素的说法中,正确的是
| A.原子半径:14Si>32Ge |
| B.稳定性:CH4<SiH4 |
| C.酸性:H2CO3>H2SiO3 |
| D.碱性:32Ge(OH)4>50Sn(OH)4>82Pb(OH)4 |
科目:高中化学 来源: 题型:单选题
下列说法正确的是( )
A.除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
B.已知MgCO3的KSP=6.82×l0-6,则在含有固体MgCO3的MgCl2、Na2CO3溶液中,都有c(Mg2+) =c(CO32-),且c(Mg2+)·c(CO32-) = 6.82×10-6 mol2.L-2
C.Ksp(AB2)小于Ksp(CD),说明AB的溶解度小于CD的溶解度
D.常温下,反应C(s)+CO2(g)==2CO(g)不能自发进行,则该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
四种短周期元素在元素周期表中的位置如右图所示,其中Z的原子半径最小。下列说法正确的是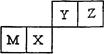
| A.M元素一定为金属元素 |
| B.X元素的最简单气态氢化物的热稳定性比Z元素的大 |
| C.若Y元素存在最高价含氧酸,其酸性比X元素的最高价含氧酸弱 |
| D.Z元素与氢元素一定能形成原子个数比为1︰1的共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
类推是一种重要的学习方法,但如果不具体问题具体分析就会得出错误结论。下列类推结论正确的是
| A.SiH4的熔沸点比CH4高,则PH3的熔沸点比NH3高 |
| B.钠在空气中燃烧生成过氧化钠,则锂在空气中燃烧生成过氧化锂 |
| C.Al(OH)3能溶于NaOH溶液,则Be(OH)2能溶于NaOH溶液 |
| D.甲酸甲酯能发生银镜反应,则乙酸甲酯能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
现有四种短周期元素的原子半径及主要化合价数据如下表所示:
| 元素 | 甲 | 乙 | 丙 | 丁 |
| 原子半径/nm | 0.186 | 0.102 | 0.152 | 0.074 |
| 主要化合价 | +1 | +6、-2 | +1 | -2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
周期表中有些元素有“对角线相似”现象,如Li、Mg;Be、Al;B、Si等两两性质相似。若用已潮解的LiCl加热蒸干并强热至熔融,再用惰性电极电解,结果得到金属锂和一种无色无味的气体。下列说法正确的是
A.LiOH易溶于水 B.电解前LiCl在加热时已发生水解
C.无色气体为电解生成的H2 D.Li和水反应要比Na和水剧烈
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期元素甲、乙、丙、丁、戊的原子序数依次增大,甲是周期表中原子半径最小的元素,乙形成的气态氢化物的水溶液呈碱性,乙与丁同族,丙、丁、戊同周期,丙单质可制成半导体材料,戊的最高化合价为+7,则 ( )。
| A.原子半径:乙>丁>丙 |
| B.非金属性:丙>丁>戊 |
| C.甲与戊形成的化合物是共价化合物 |
| D.乙、丙、丁最高价氧化物对应的水化物均是强酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com