
【题目】I. A、B、C、D四种均为含有钠元素的化合物,A、B、C与盐酸反应均可生成D;加热固体C可生成A和一种无色无味的气体X;在A溶液中通入足量X,又可生成C; B溶液和C溶液混合可生成A。请回答:
(1)A是___________,B是___________,C___________,D是___________,(均用化学式表示)
(2)写出上述反应中由A生成C的化学方程式:____________________________________。
(3)写出物质C的一种常见用途:____________________________________。
Ⅱ.化合物甲仅含两种元素。B为黄绿色气体,气体D能使湿润的红色石蕊试纸变蓝色。在一定条件下有如下转化关系:

请回答:
(1)化合物甲所含元素为__________(请填写元素符号),甲的化学式为_____________________。
(2)气体B与水反应的离子方程式为____________________________________。
(3)甲与水反应的化学方程式为____________________________________。
【答案】 Na2CO3 NaOH NaHCO3 NaCl Na2CO3+CO2+H2O=2NaHCO3 作发酵粉或治疗胃酸过多的药剂均可 N、Cl NCl3 Cl2+H2O![]() H++Cl-+HClO NCl3+3H2O=NH3+3HClO
H++Cl-+HClO NCl3+3H2O=NH3+3HClO
【解析】I. 三种含钠元素的化合物A、B、C都能与盐酸反应生成D,则D为NaCl,加热固体C可生成A和一种无色无味的气体X,说明C不稳定,在A溶液中通入足量X,又可生成C,所以C为NaHCO3,A为Na2CO3,X为CO2,NaHCO3与NaOH反应可生成Na2CO3,所以B为NaOH。则:
(1)根据上述分析,则A是Na2CO3,B是NaOH,C是NaHCO3,D是NaCl;
(2) 由A生成C的化学方程式为Na2CO3+CO2+H2O=2NaHCO3;
(3) NaHCO3常见用途有作发酵粉或治疗胃酸过多等;
Ⅱ. B为黄绿色气体,即氯气,气体D能使湿润的红色石蕊试纸变蓝色,则D为NH3,所以甲中含有的两种元素是N元素和Cl元素,由转化关系可知,甲与水反应生成的D是NH3,则E中含有氧元素,又Cl2与水反应生成盐酸和次氯酸,次氯酸中含有氧元素,所以E为次氯酸,则F为盐酸, 12.05g的甲分解生成1.4g的N2和氯气,则n(N2) =0.05mol,氯气的质量为10.65g,即n(Cl2) =0.15mol,所以甲的化学式为NCl3。则:
(1)化合物甲所含元素为N和Cl,甲的化学式为NCl3;
(2) Cl2与水反应的离子方程式为Cl2+H2O![]() H++Cl-+HClO;
H++Cl-+HClO;
(3)甲与水反应的化学方程式NCl3+3H2O=NH3+3HClO


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
【题目】为了测定乙醇的结构式,有人设计了用无水酒精与钠反应的实验装置和测定氢气体积的装置进行实验.可供选用的实验仪器如图所示: 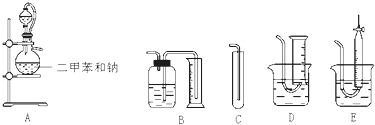
请回答以下问题:
(1)测量氢气体积的正确装置是(填写编号).
(2)装置中A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是(填写编号).
A.防止无水酒精挥发
B.保证实验装置不漏气
C.使无水酒精容易滴下
(3)实验前预先将一小块钠在二甲苯中熔化成若干个小钠珠,冷却后倒入烧瓶中,其目的是 .
(4)已知无水酒精的密度为0.789gcm﹣3 , 移取2.0mL酒精,反应完全后(钠过量),收集到390mL(视作标准状况)气体.则一个乙醇分子中能被钠取代出的氢原子数为 , 由此可确定乙醇的结构简式为而不是 .
(5)实验所测定的结果偏高,可能引起的原因是(填写编号).
A.本实验在室温下进行
B.无水酒精中混有微量甲醇
C.无水酒精与钠的反应不够完全.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于实验室制备乙烯的实验,下列说法正确的是( )
A.反应物是乙醇和过量的3摩/升硫酸的混和液
B.温度计插入反应溶液液面以下,以便控制温度在140℃
C.反应容器(烧瓶)中应加入少许瓷片
D.反应完毕先灭火再从水中取出导管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,上海某医院正在研究用放射性碘治疗肿瘤.这种碘原子的核电荷数为53,相对原子质量为125.下列关于这种原子的说法中,错误的是
A.中子数为72B.质子数为72
C.电子数为53D.质子数和中子数之和为125
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁粉和氧化铁粉末的混合物共13.6g,加入到200mL的稀硫酸中,固体完全溶解,得到标准状况下1.12L氢气。经测定,反应后的溶液中c(H+)为0.200mol·L-1,且无Fe3+(忽略反应前后溶液体积变化)。请计算:
(1)反应中放出氢气的质量为___________________。
(2)原混合物中铁和氧化铁的物质的量之比为___________________。
(3)原稀硫酸的物质的量浓度为________________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个盛有催化剂容积可变的密闭容器中,保持一定的温度和压强,进行以下反应:N2+3H22NH3 . 已知加入1molN2和4molH2时,达到平衡后生成amolNH3 . 有恒温恒压下欲保持平衡时各组分的体积分数不变.填表(恒温恒压)
已知 | 起始状态物质的量/mol | 平衡时NH3的 | ||
N2 | H2 | NH3 | ||
1 | 4 | 0 | a | |
① | 1.5 | 9 | 0 | |
② | 1 | 0.5a | ||
③ | m | g(g≥4m) | 0 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一份溶液中只有Na+、Ba2+、OH-、Cl-四种离子大量存在,经测定,c(Ba2+)=1.0mol/L,c(OH-)=1.0mol/L, c(Cl-)=1.8mol/L。试计算溶液中Na+的物质的量浓度为( )
A. 1.8mol/L B. 0.8 mol/L C. 1.0mol/L D. 0.4 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制乙烯并验证其性质,请回答下列问题:
(1)写出以乙醇为原料制取乙烯的化学方程式:________________________________________。
(2)某同学欲使用如图1所示装置制取乙烯,请你改正其中的错误:________________________。
实验过程中发现烧瓶中出现黑色固体,这会导致生成的乙烯中现有杂质气体,请写出生成杂质气体的化学方程式:__________________________________________________。
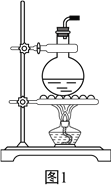
(3)要验证乙烯的化学性质(装置如图2所示,尾气处理装置已略去),请将虚线框中的装置补充完整并标出所有试剂。______________
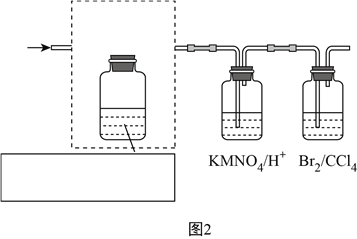
(4)有些同学提出以溴乙烷为原料制取乙烯,该反应的化学方程式为:____________________。若以溴乙烷为原料,图2中虚线框内的装置(填“能”或“不能”)__________省略,请说明理由:____________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com