
| A. | H3PO2溶于水的电离方程式为:H3PO2?3H++PO23- | |
| B. | H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+3OH-=PO23-+3H2O | |
| C. | 将H3PO2溶液加入到酸性高锰酸钾溶液中,H3PO2的还原产物为H3PO4 | |
| D. | 用惰性电极电解NaH2PO2溶液,其阳极反应式为:H2PO2-4e-+2H2O=O2↑+4H+ |
分析 A.一元弱酸在溶液中部分电离出一个氢离子;
B.一元弱酸与NaOH按照物质的量1:1反应;
C.H3PO2具有还原性,能被高锰酸钾氧化;
D.H3PO2具有较强的还原性,电解时,阳极上H2PO2-失电子.
解答 解:A.一元弱酸在溶液中部分电离出一个氢离子,则H3PO2溶于水的电离方程式为:H3PO2?H++H2PO2-,故A错误;
B.一元弱酸与NaOH按照物质的量1:1反应,所以H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+OH-═H2PO2-+H2O,故B错误;
C.H3PO2具有还原性,能被高锰酸钾氧化,则将H3PO2溶液加入到酸性高锰酸钾溶液中,H3PO2的氧化产物为H3PO4,故C错误;
D.H3PO2具有较强的还原性,电解时,阳极上H2PO2-失电子,所以用惰性电极电解NaH2PO2溶液,其阳极反应式为:H2PO2--4e-+2H2O═H3PO4+3H+,故D正确;
故选D.
点评 本题考查氧化还原反应、电离方程式的书写、电解原理的应用等知识点,明确物质的性质是解本题关键,利用电极方程式的书写方法、电离方程式书写规则、盐类水解原理解答即可,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 有氧化性、无还原性、无酸性 | B. | 无氧化性、有还原性、无酸性 | ||
| C. | 有氧化性、有还原性、有酸性 | D. | 有氧化性、无还原性、有酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
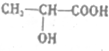 .
.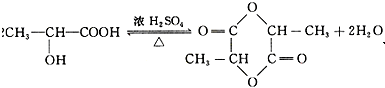 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
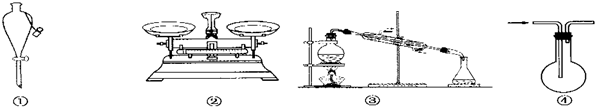
| A. | 仪器①可用于乙醇与水分离提纯 | |
| B. | 仪器②可用于称取5.85 g氯化钠固体 | |
| C. | 装置③的烧瓶中应加沸石,以防暴沸 | |
| D. | 装置④从箭头方向进气,用排空气法可收集H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
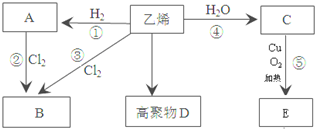
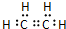 ,C中所含官能团的名称羟基;
,C中所含官能团的名称羟基;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
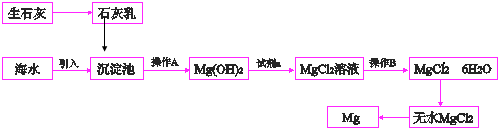
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com