
| A、扩大体积使压强减小 |
| B、体积不变充入N2使压强增大 |
| C、体积不变充入He使压强增大 |
| D、压强不变充入He |


 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
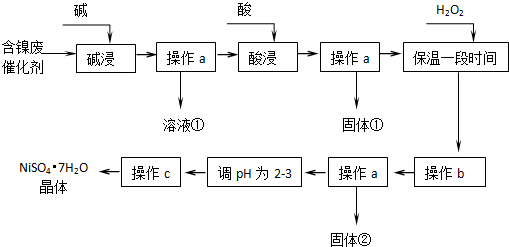
| 沉淀物 | 开始沉淀 | 完全沉淀 |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| n(Fe3+) |
| n(Fe 2+) |
| n(Fe 3+) |
| n(Fe 2+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(N2)c2(CO2) |
| c2(CO)c2(NO) |
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| n(NO)/mol | 1.000 | 0.450 | 0.250 | 0.150 | 0.100 | 0.100 | 0.092 |
| n(CO)/mol | 3.600 | 3.050 | 2.850 | 2.750 | 2.700 | 2.700 | 2.692 |
| n(N2)/mol | 0 | 0.275 | 0.375 | 0.425 | 0.450 | 0.450 | 0.454 |
| n(CO2)/mol | 0 | 0.550 | 0.750 | 0.850 | 0.900 | 0.900 |
| 生成SO2的质量(g) | 生成SO3的质量(g) | |
| 3g硫在空气中燃烧 | 5.64~5.70 | 0.375~0.45 |
| 3g硫在纯氧中燃烧 | 5.82~5.88 | 0.15~0.225 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验目的 | 实验操作 | |
| A | 鉴别CO32-和 SO42- | 分别加入饱和CaCl2溶液 |
| B | 比较Al和Fe的金属活动性 | 分别加入浓NaOH溶液 |
| C | 比较苯酚和乙酸的酸性 | 分别加入NOH溶液 |
| D | 比较AgCl和AgI的溶解度 | 向AgCl的饱和液中加少量KI溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(X) |
| c(W) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com