
| 实验目的 | 实验操作 | |
| A | 鉴别CO32-和 SO42- | 分别加入饱和CaCl2溶液 |
| B | 比较Al和Fe的金属活动性 | 分别加入浓NaOH溶液 |
| C | 比较苯酚和乙酸的酸性 | 分别加入NOH溶液 |
| D | 比较AgCl和AgI的溶解度 | 向AgCl的饱和液中加少量KI溶液 |
| A、A | B、B | C、C | D、D |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:
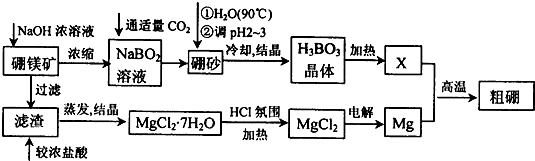
2- 3 |
2- 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、扩大体积使压强减小 |
| B、体积不变充入N2使压强增大 |
| C、体积不变充入He使压强增大 |
| D、压强不变充入He |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、x>y | B、x=y |
| C、x<y | D、x≥y |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3:1:1 |
| B、6:3:2 |
| C、1:2:3 |
| D、1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲溶液含有Ba2+ |
| B、乙溶液含有SO42- |
| C、丙溶液含有Cl- |
| D、丁溶液含有Mg2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com