
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
 ,故答案为:
,故答案为: ;
;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、16 g |
| B、32 g |
| C、64 g?mol-1 |
| D、32 g?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、进入煤矿井时,用火把照明 |
| B、在开阔广场燃放烟花爆竹 |
| C、用点燃的火柴检验液化气钢瓶是否漏气 |
| D、进入下水道时,应用蜡烛照明 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
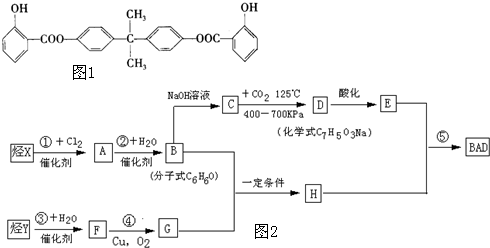
查看答案和解析>>
科目:高中化学 来源: 题型:
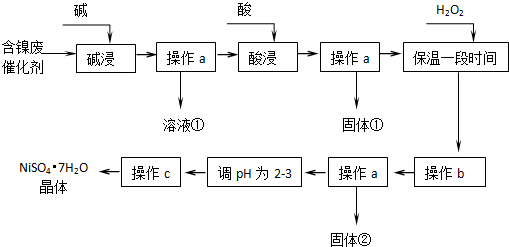
| 沉淀物 | 开始沉淀 | 完全沉淀 |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验目的 | 实验操作 | |
| A | 鉴别CO32-和 SO42- | 分别加入饱和CaCl2溶液 |
| B | 比较Al和Fe的金属活动性 | 分别加入浓NaOH溶液 |
| C | 比较苯酚和乙酸的酸性 | 分别加入NOH溶液 |
| D | 比较AgCl和AgI的溶解度 | 向AgCl的饱和液中加少量KI溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com