


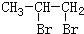 ,B发生水解反应生成C为
,B发生水解反应生成C为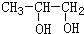 ,C发生氧化反应生成D,由C、D分子式可知,D为
,C发生氧化反应生成D,由C、D分子式可知,D为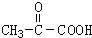 ,D与氢气发生加成反应生成E为
,D与氢气发生加成反应生成E为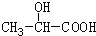 ,E与乙醇发生酯化反应生成F为
,E与乙醇发生酯化反应生成F为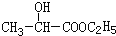 ,F在浓硫酸、加热条件下发生消去反应生成G为CH2=CHCOOCC2H5,G发生加聚反应生成高聚物H为
,F在浓硫酸、加热条件下发生消去反应生成G为CH2=CHCOOCC2H5,G发生加聚反应生成高聚物H为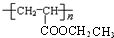 ,据此解答.
,据此解答.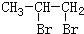 ,B发生水解反应生成C为
,B发生水解反应生成C为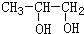 ,C发生氧化反应生成D,由C、D分子式可知,D为
,C发生氧化反应生成D,由C、D分子式可知,D为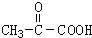 ,D与氢气发生加成反应生成E为
,D与氢气发生加成反应生成E为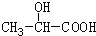 ,E与乙醇发生酯化反应生成F为
,E与乙醇发生酯化反应生成F为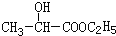 ,F在浓硫酸、加热条件下发生消去反应生成G为CH2=CHCOOCC2H5,G发生加聚反应生成高聚物H为
,F在浓硫酸、加热条件下发生消去反应生成G为CH2=CHCOOCC2H5,G发生加聚反应生成高聚物H为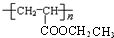 ,
,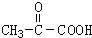 ,
,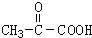 ;
;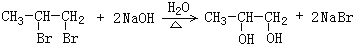 ;E→F的反应方程式为:
;E→F的反应方程式为: ,
,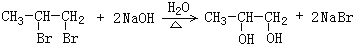 ;
; .
.


科目:高中化学 来源: 题型:
| A、5.6g铁粉与足量Cl2反应,失去的电子数为0.2NA |
| B、欲配置1.00L,1.00mol?L-1的NaCl溶液,可将58.5g NaCl溶于1.00L水中 |
| C、标准状况下,11.2L CH3CH2OH中含有分子的数目为0.5NA |
| D、常温常压下,8g氧气含有4NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
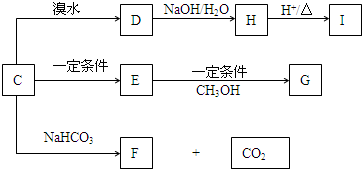
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、R是第ⅣA族元素 |
| B、R可形成两种氧化物RO2、RO3 |
| C、R可能处于第二周期 |
| D、R的原子序数可能为24 |
查看答案和解析>>
科目:高中化学 来源: 题型:
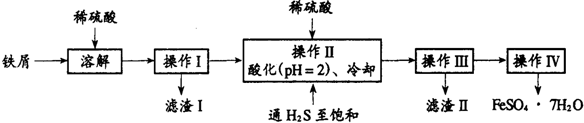
查看答案和解析>>
科目:高中化学 来源: 题型:
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:
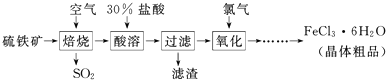
| △ |
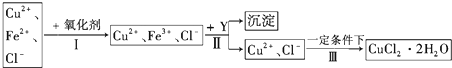
查看答案和解析>>
科目:高中化学 来源: 题型:
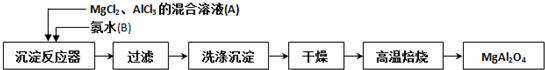
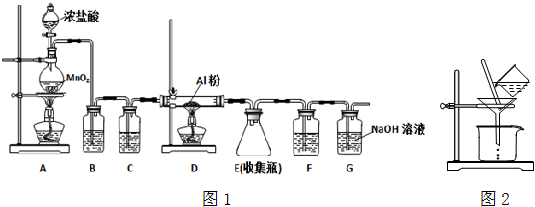
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com