
| A、R是第ⅣA族元素 |
| B、R可形成两种氧化物RO2、RO3 |
| C、R可能处于第二周期 |
| D、R的原子序数可能为24 |


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
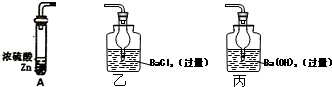
查看答案和解析>>
科目:高中化学 来源: 题型:
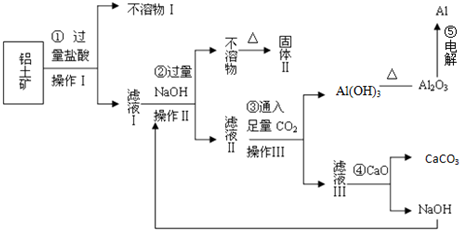
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、进入煤矿井时,用火把照明 |
| B、在开阔广场燃放烟花爆竹 |
| C、用点燃的火柴检验液化气钢瓶是否漏气 |
| D、进入下水道时,应用蜡烛照明 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Li能在空气中燃烧 |
| B、Li2O熔点较低 |
| C、Li2CO3能溶于水 |
| D、LiOH受热不易分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
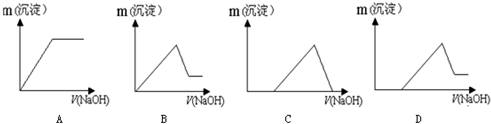
查看答案和解析>>
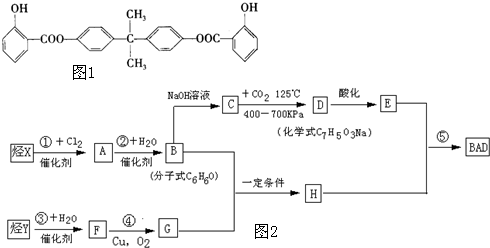
科目:高中化学 来源: 题型:

| n(Fe3+) |
| n(Fe 2+) |
| n(Fe 3+) |
| n(Fe 2+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com