
| A、Li能在空气中燃烧 |
| B、Li2O熔点较低 |
| C、Li2CO3能溶于水 |
| D、LiOH受热不易分解 |


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
| A、M与X形成的化合物对应的水化物一定是强酸 |
| B、Y2X和Y2X2中阴、阳离子的个数比相同,化学键类型也完全相同 |
| C、X、Y的简单离子半径:r(X2-)>r(Y+) |
| D、M的气态氢化物比N的气态氢化物稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
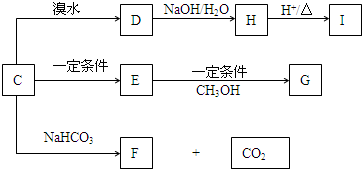
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、R是第ⅣA族元素 |
| B、R可形成两种氧化物RO2、RO3 |
| C、R可能处于第二周期 |
| D、R的原子序数可能为24 |
查看答案和解析>>
科目:高中化学 来源: 题型:
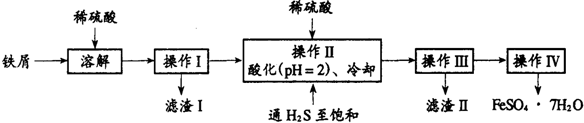
查看答案和解析>>
科目:高中化学 来源: 题型:
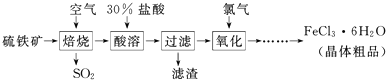
| △ |
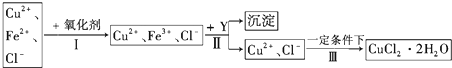
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学反应及平衡常数 | 平衡常数数值 | ||
| 500℃ | 800℃ | ||
| ①2H2O(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | 2.5 | 0.375 |
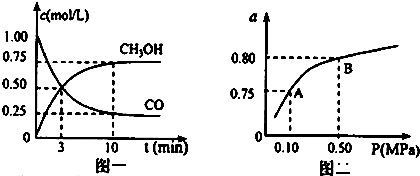
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com