

| 一定条件 |
| 一定条件 |
| Cu |
| △ |
| Cu |
| △ |


科目:高中化学 来源: 题型:
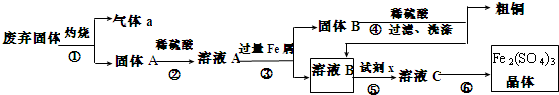
查看答案和解析>>
科目:高中化学 来源: 题型:
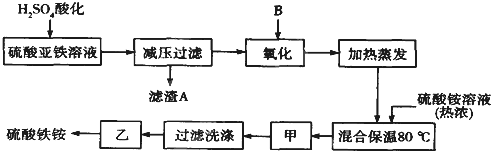
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Li能在空气中燃烧 |
| B、Li2O熔点较低 |
| C、Li2CO3能溶于水 |
| D、LiOH受热不易分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、第ⅥA族元素从上到下,其氢化物的稳定性逐渐减弱 |
| B、L层电子数为奇数的所有元素都是非金属元素 |
| C、ⅦA族元素阴离子的还原性越强,元素的最高价氧化物对应水化物的酸性也越强 |
| D、同一主族的甲乙两种元素,甲的原子序数为a,则乙的原子序数可能为a+4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
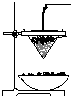 铁砂的主要成分是微粒状的磁性氧化铁、石英、石灰石等混合物.某化学兴趣小组从铁砂中分离出磁性氧化铁,并进行铝热反应实验.
铁砂的主要成分是微粒状的磁性氧化铁、石英、石灰石等混合物.某化学兴趣小组从铁砂中分离出磁性氧化铁,并进行铝热反应实验.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a mol X+a mol Y |
| B、2a mol Z |
| C、a mol X+a mol Z |
| D、a mol Y+a mol Z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com