
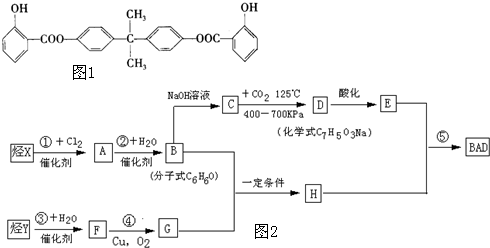
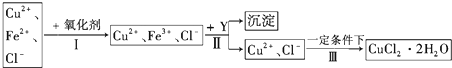
 ,H为
,H为 ,根据D的分子式结合E的结构可知D为
,根据D的分子式结合E的结构可知D为 ,再根据B的分子式可知B为
,再根据B的分子式可知B为 ,C为苯酚钠,则A为
,C为苯酚钠,则A为 ,烃X为
,烃X为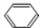 .F在Cu为催化剂条件下发生催化氧化生成G,G不能发生银镜反应,结合B和H的结构可知G为
.F在Cu为催化剂条件下发生催化氧化生成G,G不能发生银镜反应,结合B和H的结构可知G为 ,则F为CH3CH(OH)CH3,烃Y为CH3CH=CH2,据此解答.
,则F为CH3CH(OH)CH3,烃Y为CH3CH=CH2,据此解答. ,H为
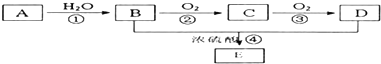
,H为 ,根据D的分子式结合E的结构可知D为
,根据D的分子式结合E的结构可知D为 ,再根据B的分子式可知B为
,再根据B的分子式可知B为 ,C为苯酚钠,则A为
,C为苯酚钠,则A为 ,烃X为
,烃X为 .F在Cu为催化剂条件下发生催化氧化生成G,G不能发生银镜反应,结合B和H的结构可知G为
.F在Cu为催化剂条件下发生催化氧化生成G,G不能发生银镜反应,结合B和H的结构可知G为 ,则F为CH3CH(OH)CH3,烃Y为CH3CH=CH2,
,则F为CH3CH(OH)CH3,烃Y为CH3CH=CH2, ,故答案为:CH3CH=CH2;
,故答案为:CH3CH=CH2; ;
; ,能和氢氧化钠溶液反应的官能团有酚羟基、酯基,酯基为羧基与酚羟基形成,1mol酯基可以消耗2mol氢氧化钠,硅所以1molBAD最多可与含6molNaOH的溶液完全反应,故答案为:6;
,能和氢氧化钠溶液反应的官能团有酚羟基、酯基,酯基为羧基与酚羟基形成,1mol酯基可以消耗2mol氢氧化钠,硅所以1molBAD最多可与含6molNaOH的溶液完全反应,故答案为:6; ,
, ,
, ;
; .
.


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、R是第ⅣA族元素 |
| B、R可形成两种氧化物RO2、RO3 |
| C、R可能处于第二周期 |
| D、R的原子序数可能为24 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 3 |
2- 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、x>y | B、x=y |
| C、x<y | D、x≥y |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com