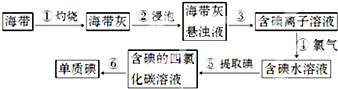
2012年冬季,我国城市空气污染状况受到人们的强烈关注,其中NO
x、CO、SO
2是主要污染性气体.
I.汽车内燃机工作时,氮气和氧气反应生成NO气体是导致汽车尾气中含有NO的重要原因之一,已知:每生成30gNO气体吸收90.4KJ热量.
(1)试写出内燃机工作时生成NO的热化学方程式:
;
(2)利用催化技术可将汽车尾气中的NO气体转化成无毒气体,相关反应的平衡常数可表示为k=
,此反应为放热反应.在一定温度下,10L某密闭容器中发生上述反应,各物质的物质的量的变化情况如表
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| n(NO)/mol | 1.000 | 0.450 | 0.250 | 0.150 | 0.100 | 0.100 | 0.092 |
| n(CO)/mol | 3.600 | 3.050 | 2.850 | 2.750 | 2.700 | 2.700 | 2.692 |
| n(N2)/mol | 0 | 0.275 | 0.375 | 0.425 | 0.450 | 0.450 | 0.454 |
| n(CO2)/mol | 0 | 0.550 | 0.750 | 0.850 | 0.900 | 0.900 | |
①根据上表数据计算0~4s间用NO表示的平均速率υ(NO)=
;达到化学平衡时两种反应物的转化率是否相等
(填“相等”或“不相等”).
②在5~6s时,若K增大,5s后正反应速率
(填“增大”或“减小”)
③在5~6s时,若K不变,以上各物质的物质的量变化原因可能是
;
A.选用更有效的催化剂B.缩小容器的体积C.降低CO
2浓度 D.升高温度
Ⅱ为探究硫在氧气中燃烧的产物里是否有SO
3,某化学兴趣小组在绝热环境下进行了定量实验探究.探究实验的相关数据如表
| 生成SO2的质量(g) | 生成SO3的质量(g) |
| 3g硫在空气中燃烧 | 5.64~5.70 | 0.375~0.45 |
| 3g硫在纯氧中燃烧 | 5.82~5.88 | 0.15~0.225 |
(3)对数据进行分析可知,等质量的硫在纯氧中燃烧产生的SO
3比在空气中燃烧产生的SO
3
(填“多”或“少”),原因可能是
(填序号字母)
A.纯氧中氧气浓度高,有利于化学平衡2SO
2(g)+O
2(g)═2SO
3(g)△H=Q kJ?mol
-1向右移动
B.化学反应2SO
2(g)+O
2(g)═2SO
3(g)△H=Q kJ?mol
-1中的Q<0
C.纯氧中氧气浓度高,单位时间内发热量大,致使反应体系的温度较高,不利于化学平衡2SO
2(g)+O
2(g)═2SO
3(g)△H=Q kJ?mol
-1向右移动
D.3g硫在纯氧中燃烧比3g硫在空气中燃烧放出的热量多,不利于化学平衡2SO
2(g)+O
2(g)═2SO
3(g)△H=Q kJ?mol
-1向右移动.



 智慧小复习系列答案
智慧小复习系列答案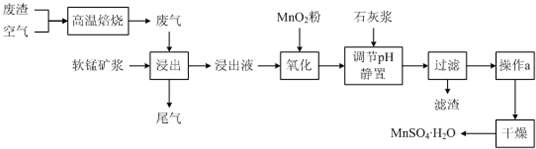
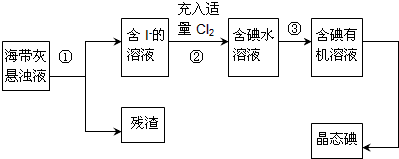
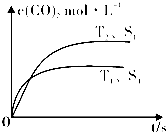 2014年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一.
2014年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一.