
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
| 8.4g/m3×1000m3×90% |
| 64g/mol |


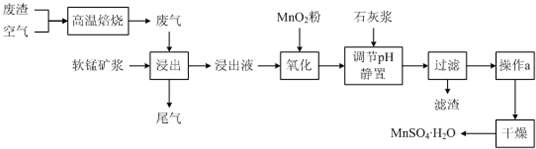
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径大小顺序为:E>D>C>B>A |
| B、A、B、C、D四种元素都属于非金属元素,它们之间只能形成共价化合物 |
| C、B、C、D、E四种元素与A 元素形成的最简单化合物的沸点依次升高 |
| D、D与A、E均可形成具有强氧化性的化合物,可用于城市自来水的杀菌消毒 |
查看答案和解析>>
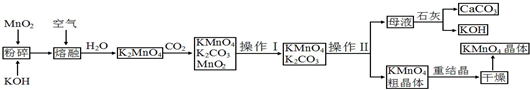
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
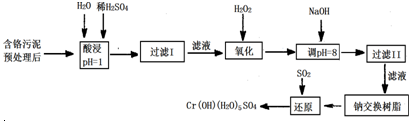
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(N2)c2(CO2) |
| c2(CO)c2(NO) |
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| n(NO)/mol | 1.000 | 0.450 | 0.250 | 0.150 | 0.100 | 0.100 | 0.092 |
| n(CO)/mol | 3.600 | 3.050 | 2.850 | 2.750 | 2.700 | 2.700 | 2.692 |
| n(N2)/mol | 0 | 0.275 | 0.375 | 0.425 | 0.450 | 0.450 | 0.454 |
| n(CO2)/mol | 0 | 0.550 | 0.750 | 0.850 | 0.900 | 0.900 |
| 生成SO2的质量(g) | 生成SO3的质量(g) | |
| 3g硫在空气中燃烧 | 5.64~5.70 | 0.375~0.45 |
| 3g硫在纯氧中燃烧 | 5.82~5.88 | 0.15~0.225 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com