
| A、原子半径大小顺序为:E>D>C>B>A |
| B、A、B、C、D四种元素都属于非金属元素,它们之间只能形成共价化合物 |
| C、B、C、D、E四种元素与A 元素形成的最简单化合物的沸点依次升高 |
| D、D与A、E均可形成具有强氧化性的化合物,可用于城市自来水的杀菌消毒 |


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
| A、①③⑦ | B、②⑥⑦ |
| C、①③④ | D、③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构, 且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | |
| Z | W |
| A、原子半径:Z>X>Y |
| B、最高价氧化物对应水化物的酸性:Z>W |
| C、W的单质是制取盐酸的原料之一 |
| D、X、W的氢化物相遇会产生白烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④⑥ | B、①③⑤ |
| C、①③⑤⑥ | D、③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
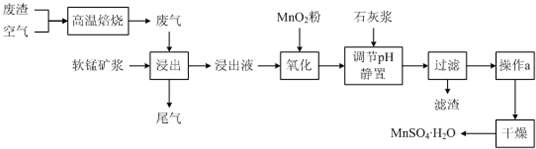
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
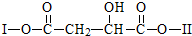 (其中I、II为未知部分的结构)为推测X的分子结构,进行如图的转化:
(其中I、II为未知部分的结构)为推测X的分子结构,进行如图的转化: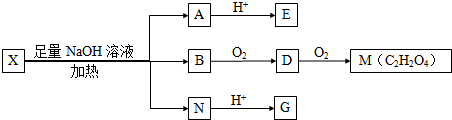
查看答案和解析>>
科目:高中化学 来源: 题型:
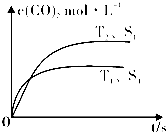 2014年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一.
2014年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一.| 催化剂 |
| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com