
【题目】铜及其化合物在生产生活中有着广泛的应用。请回答下列问题:
(1)铜元素位于元素周期表中_____区,基态Cu原子有______种不同能级的电子。
(2)铜合金可用于制造航母螺旋桨。制造过程中产生的含铜废液可利用铜萃取剂M,通过如下反应实现铜离子的富集回收。
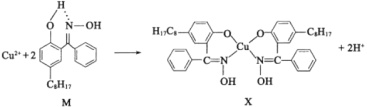
①M所含元素的电负性由大到小的顺序为______(用元素符号表示)。
②X中采用sp3杂化的非金属原子有______(填元素名称)。
(3)在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体Y产生。Y分子的立体构型是_______,Y的沸点比水低的主要原因是_______。
(4)向蓝色{[Cu(H2O)4]2+}硫酸铜溶液中加入稍过量的氨水,溶液变为深蓝色{[Cu(NH3)4]2+}。通过上述实验现象可知,与Cu2+的配位能力:H2O________NH3(填“大于”或“小于”)。
(5)CuCl2和CuCl是铜的两种氯化物。
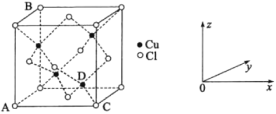
①图中表示的是_______(填“CuCl2”或“CuCl”)的晶胞。
②原子坐标参数可用来表示晶胞内各原子的相对位置,图中各原子坐标参数A为(0,0,0);B为(0,1,1);C为(1,0,0);则D原子的坐标参数为______。
③晶胞中C、D两原子核间距为298 pm,阿伏加德罗常数的值为NA,则该晶体密度为__g·cm-3(列出计算式即可)。
【答案】ds 7(或七) O>N>C>H 碳、氧 V形(或角形) 水分子间存在氢键,H2S分子间不存在氢键 小于 CuC1 (![]() ,
,![]() ,
,![]() )
) 
【解析】
(1)铜为29号元素,核外电子排布式为1s22s22p63s23p63d104s1,在反应时不仅最外层4s电子发生变化,次外层的3d电子也发生变化,Cu元素位于元素周期表第四周期第IB族,属于ds区元素,共有1s、2s、2p、3s、3p、3d、4s七个能级;
(2)①由于元素的非金属性越强,其电负性越大。根据M结构简式可知:M中含有C、H、O、N四种元素,这四种元素的非金属性:O>N>C>H,所以元素的电负性由大到小的顺序为O>N>C>H;
②在X分子中含有的饱和C原子及O原子价层电子对数为4,采用sp3杂化;N原子采用sp2杂化,故X中采用sp3杂化的非金属元素有碳、氧两种元素;
(3)在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体Y产生。Y是H2S,在H2S分子中,S原子价层电子对数为4,由于S原子上有2对孤电子对,占据了2个轨道,孤电子对对成键电子对的排斥作用大于成键电子对的排斥作用,使H2S分子立体构型为V形(或角形);H2S、H2O都是由分子构成的物质,由于在H2O分子之间存在氢键,增加了分子之间的相互作用力,而H2S分子之间无氢键,只存在分子间作用力,因而H2O的沸点比H2S高;
(4)在水溶液中存在蓝色[Cu(H2O)4]2+,向含有该离子的硫酸铜溶液中加入稍过量的氨水,溶液变为深蓝色,反应产生[Cu(NH3)4]2+离子,说明配位体NH3与Cu2+结合能力比配位体H2O强,即与Cu2+的配位能力:H2O小于NH3;
(5)①白色球为Cl原子,黑色球为Cu原子,晶胞中Cu原子为4个,Cl原子数目为8×![]() +6×
+6×![]() =4,Cu和Cl原子的数目为1:1,故物质化学式为CuCl;
=4,Cu和Cl原子的数目为1:1,故物质化学式为CuCl;
②D与C的连线处于晶胞体对角线上,且DC长度等于晶胞体对角线BC长度的![]() ,所以z=
,所以z=![]() ;D到左侧平面(即坐标系yoz面)的距离等于晶胞棱长的
;D到左侧平面(即坐标系yoz面)的距离等于晶胞棱长的![]() ,则x=
,则x=![]() ;D到前平面(即坐标系xoz面)的距离等于晶胞棱长的
;D到前平面(即坐标系xoz面)的距离等于晶胞棱长的![]() ,即参数y=
,即参数y=![]() ,故D的坐标参数为(
,故D的坐标参数为(![]() ,
,![]() ,
,![]() );
);
③晶胞中C,D两原子核间距为298 pm,则晶胞体对角线长度为4×298 pm,晶胞体对角线长度等于晶胞棱长的![]() 倍,晶胞质量m=
倍,晶胞质量m=![]() g,所以晶胞的密度ρ=
g,所以晶胞的密度ρ=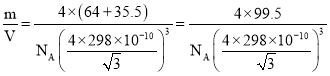 g/cm3。
g/cm3。


科目:高中化学 来源: 题型:
【题目】Weiss利用光敏剂QD制备2—环已基苯乙烯(c)的过程如图。下列说法不正确的是( )
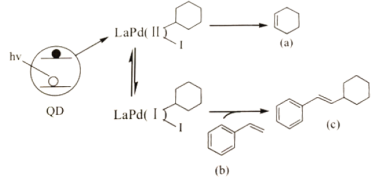
A.a的二氯代物有3种
B.1molb完全燃烧消耗10molO2
C.c具有顺式和反式2种结构
D.a、b、c均能使溴水和稀高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中选用的部分仪器,不合理的是( )
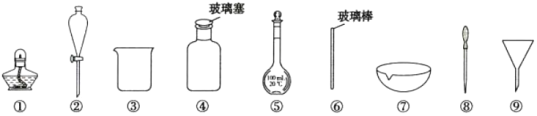
A.配制100 mL0.1 mol·L-1NaC1溶液,选用③、⑤、⑥和⑧
B.盛放NaOH溶液,选用④
C.分离I2的四氯化碳溶液和水,选用②、③
D.从食盐水中获得食盐,选用①、⑥、⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用发烟HC1O4将潮湿的CrC13氧化为棕色的烟[CrO2(C1O4)2],来除去Cr(Ⅲ),HC1O4中部分氯元素转化为最低价态。下列说法错误的是( )
A.CrO2(C1O4)2中Cr元素显+6价
B.HC1O4属于强酸,该反应还生成了另一种强酸
C.该反应中,参加反应的氧化剂与氧化产物的物质的量之比为3:8
D.该反应离子方程式为19ClO![]() +8Cr3++8OH-=8CrO2(ClO4)2+3C1-+4H2O
+8Cr3++8OH-=8CrO2(ClO4)2+3C1-+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看做化学平衡。请根据所学的知识回答:
(1)0.1 mol·L-1的NH4Cl溶液,在该溶液中各种离子的浓度由大到小顺序为_________。
(2)0.1 mol·L-1 NaHCO3溶液,请分析NaHCO3溶液显碱性的原因:________。
(3)FeCl3溶液,实验室中配制FeCl3溶液时常加入____________以抑制其水解。
(4)向含有AgI固体的饱和溶液中:
①加入固体AgNO3,则c(I-)_____(填“变大”、“ 变小”或“不变”,下同),c(Ag+)__。
②若改加更多的AgI,则c(Ag+)将____。
③若改加Na2S固体,则c(I-)____,c(Ag+)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】计算下列各题在常温下的数值(lg2=0.3、lg3=0.477、lg5=0.7)。
(1)0.005mol/L的氢氧化钡溶液的PH=____。
(2)0.1mol/L的醋酸的PH=_____(电离度=1%)。
(3)pH=12的NaOH溶液加水稀释到原来的10倍,则溶液的pH=_____。
(4)pH=12氨水加水稀释到原来100倍,溶液的pH值范围___________。
(5)PH=1和PH=3的硫酸等体积混合后溶液的PH=______,c(H+)水=_____。
(6)pH=13 的强碱与 pH=2 的强酸溶液混合,所得混合液的 pH=11,则强碱与强酸的体积比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用除去表面氧化膜的细铝条紧紧缠绕在温度计上(如图),将少许硝酸汞溶液滴到铝条表面,置于空气中,很快铝条表面产生“白毛”,且温度明显上升。下列分析错误的是

A.Al和O2化合放出热量B.硝酸汞是催化剂
C.涉及了:2Al+3Hg2+→2Al3++3HgD.“白毛”是氧化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用硫酸铁溶液与铜粉反应,又向反应后溶液中加入KSCN溶液以检验Fe3+是否有剩余,实验记录如下;
实验编号 | 操作 | 现象 |
实验1 |
| i.加入Cu粉后充分振荡,溶液逐渐变蓝; ii.取少量i中清液于试管中,滴加2滴 0.2mol/LKSCN溶液,溶液变为红色,但振荡后红色迅速褪去并有白色沉淀生成。 |
(1)写出实验1中第i步的离子方程式_______________。甲同学猜想第ii步出现的异常现象是由于溶液中的Cu2+干扰了检验Fe3+的现象。查阅相关资料如下
①2Cu2++4SCN- ![]() 2CuSCN↓(白色)+(SCN)2(黄色)
2CuSCN↓(白色)+(SCN)2(黄色)
②硫氰[(SCN)2]:是一种拟卤素,性质与卤素单质相似,其氧化性介于Br2和I2之间。
该同学又通过如下实验验证猜想
实验编号 | 操作 | 现象 |
实验2 |
| 溶液呈绿色,一段时间后后开始出现白色沉淀,上层溶液变为黄色 |
实验3 |
| 无色溶液立即变红,同时生成白色沉淀。 |
(2)经检测,实验2反应后的溶液pH值减小,可能的原因是___________________________________________。
(3)根据实验2、3的实验现象,甲同学推断实验3中溶液变红是由于Fe2+被(SCN)2氧化,写出溶液变红的离子方程式_______________________。继续将实验2中的浊液进一步处理,验证了这一结论的可能性。
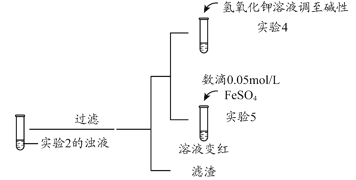
补充实验4的目的是排除了溶液存在Cu2+的可能,对应的现象是____________________________________________。
(4)乙同学同时认为,根据氧化还原反应原理,在此条件下,Cu2+也能氧化Fe2+,他的判断依据是_______。
(5)为排除干扰,小组同学重新设计如下装置。
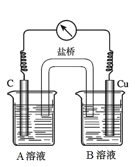
①A溶液为____________________________。
②“电流表指针偏转,说明Cu与Fe3+发生了反应”,你认为这种说法是否合理?__________________(填合理或不合理),原因是__________________________________________。
③验证
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuH不稳定,易跟盐酸反应:2CuH+2HCl![]() CuCl2+2H2↑+Cu。下列说法正确的是
CuCl2+2H2↑+Cu。下列说法正确的是
A. CuH中H的化合价为+1 B. CuH在反应中只被还原
C. 在反应中HCl失去电子 D. Cu是反应的还原产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com