
【题目】SO2、NO是大气污染物,NH4NO3、H2SO4等是水体污染物,有效去除这些污染物是一项重要课题。
(1)NO、SO2可以先氧化,后用碱吸收。其氧化过程的反应原理如下:
NO(g)+O3(g)NO2(g)+O2(g) H1=-200.9kJ/mol
SO2(g)+O3(g) SO3(g)+O2(g) H2=-241.6kJ/mol
2SO2(g)+O2(g) 2SO3(g) H3=-196.6kJ/mol
则反应2NO2(g) 2NO(g)+O2(g)的H=___kJ/mol
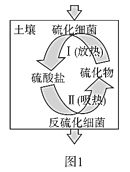
(2)土壤中的硫循环如图1所示。
①土壤中的黄铁矿(FeS2)在过程I中会转化成硫酸亚铁和硫酸。该过程发生反应的化学方程式为_____;
②某种反硫化细菌在过程II中需要有乳酸参与反应消耗硫酸生成H2S并伴有热量放出,那么乳酸除在反应中作还原剂外,还存在另一作用,请解释原因:_____;
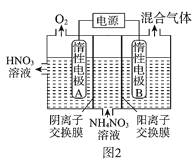
(3)电解法除去工业废水中的硝酸铵的装置示意图如图2所示,阴极电极反应式为____;
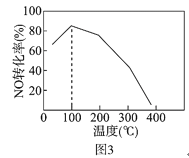
(4)向恒容密闭容器中充入1molNO和2molO3,发生如下反应:NO(g)+O3(g) NO2(g)+O2(g) △H<0不同温度下反应相同时间后,体系中NO转化率随温度变化曲线如图3。温度低于100℃时,NO转化率随温度升高而增大的主要原因是_____;当温度高于100℃时,NO转化率随温度升高而降低,原因是_____。
【答案】+115.2 2FeS2+7O2+2H2O=2FeSO4+2H2SO4 因为过程II(反硫化过程)吸热,乳酸和硫酸反应放出的热量使温度升高促进了过程II(反硫化过程)的进行;[或:因为过程II(反硫化过程)吸热,需要反硫化细菌提供能量(ATP),而乳酸和硫酸反应放出热量提供给反硫化细菌(以ATP形式),使过程II(反硫化过程)进行] 2NH4++2e-=2NH3↑+H2↑ 低于100℃时,相同时间内反应未达到平衡状态。温度升高,化学反应速率加快,NO即时转化率高 100℃时,在相同时间内,反应达到平衡,由于该反应是放热反应,温度升高平衡左移,NO平衡转化率降低
【解析】
(1)根据盖斯定律计算(②-①)×2得到反应2NO2(g)2NO(g)+O2(g)的△H;
(2)①土壤中的黄铁矿(FeS2)在过程Ⅰ中和氧气、水反应会转化成硫酸亚铁和硫酸;
②某种反硫化细菌在过程Ⅱ中需要有乳酸参与反应消耗硫酸,生成H2S并伴有热量放出,那么乳酸除在反应中作还原剂外,乳酸和硝酸反应放出的热量使温度升高促进了过程Ⅱ的进行;
(3)装置图中放出氧气的为阳极,溶液中铵根离子在阴极得到电子生成混合气体为氨气和氢气;
(4)温度低于100℃时,NO转化率随温度升高而增大是反应为达到平衡状态,反应正向进行,已知温度高时,O3分解生成活性极高的氧原子,NO转化率随温度升高而降低,由于反应为放热反应,随温度升高平衡逆向进行,同时发生反应NO2+O=NO+O2使转化率降低。
(1)已知:①NO(g)+O3(g)NO2(g)+O2(g)△H1=200.9kJmol1
②SO2(g)+O3(g)SO3(g)+O2(g)△H2=241.6kJmol1
③2SO2(g)+O2(g)2SO3(g)△H3=196.6kJmol1
盖斯定律计算(②-①)×2得到反应2NO2(g)2NO(g)+O2(g)的△H=+115.2kJ/mol;
(2)①土壤中的黄铁矿(FeS2)在过程Ⅰ中和氧气、水反应会转化成硫酸亚铁和硫酸,反应的化学方程式:2FeS2+7O2+2H2O=2FeSO4+2H2SO4;
②土壤中的黄铁矿(FeS2)在过程Ⅰ中和氧气、水反应会转化成硫酸亚铁和硫酸;某种反硫化细菌在过程Ⅱ中需要有乳酸参与反应消耗硫酸,生成H2S并伴有热量放出,那么乳酸除在反应中作还原剂外,乳酸和硝酸反应放出的热量使温度升高促进了过程Ⅱ的进行[或:因为过程II(反硫化过程)吸热,需要反硫化细菌提供能量(ATP),而乳酸和硫酸反应放出热量提供给反硫化细菌(以ATP形式),使过程II(反硫化过程)进行];
(3)电解法除去工业废水中的硝酸铵是铵根离子得到电子生成氨气和氢气,电极反应:2NH4++2e=2NH3↑+H2↑;
(4)温度低于100℃时,NO转化率随温度升高而增大的主要原因是:低于100℃,反应速率慢相同时间内还没有达到平衡状态,已知温度高时,O3分解生成活性极高的氧原子,NO转化率随温度升高而降低,可能的原因有:温度高时反应速率快,相同时间内已经达到平衡状态,由于反应为放热反应,随温度升高平衡逆向进行,同时发生反应NO2+O=NO+O2使转化率降低。


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:
【题目】为研究废旧电池的再利用,实验室利用旧电池的铜帽(主要成分为Zn和Cu)回收Cu并制备ZnO的部分实验过程如图所示。下列叙述错误的是
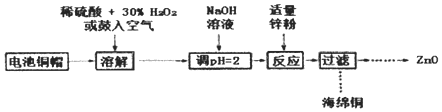
A.“溶解”操作中溶液温度不宜过髙
B.铜帽溶解的反应可能有H2O2+Cu+2H+=Cu2++2H2O
C.与锌粉反应的离子可能是Cu2+、H+
D.“过滤”操作后,将滤液蒸发结晶、过滤、洗涤、干燥后高温灼烧即可得纯净的ZnO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备溴苯的反应装置如图所示,回答下列问题:
已知:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
水中的溶解度 | 微溶 | 微溶 | 微溶 |
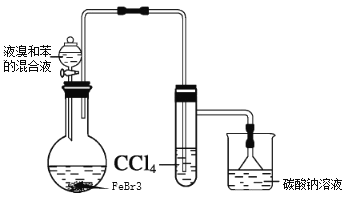
(1)实验装置c的作用为_______。
(2)写出实验室制备溴苯的反应方程式_______。
(3)本实验得到粗溴苯后,除去铁屑,再用如下操作精制:a蒸馏;b水洗;c用干燥剂干燥;d 10%NaOH溶液洗涤;e水洗,正确的操作顺序是________。
(4)本实验使用6mL无水苯、4.0mL液溴和少量铁屑,充分反应,经精制得到6.5mL的溴苯。则该实验中溴苯的产率是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需配制500mL 0.2mol/L Na2SO4溶液,实验操作步骤为:
A.把制得的溶液小心地转移至容量瓶中。
B.在天平上称取14.2g 硫酸钠固体,把它放在烧杯中,用适量的蒸馏水将它完全溶解并冷却至室温。
C.继续向容量瓶中加蒸馏水至液面距刻度1~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切。
D.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心注入容量瓶,并轻轻振荡。
E.将容量瓶塞塞紧,充分摇匀。
请填写下列空白:
(1)操作步骤的正确顺序为_______________(填序号)。
(2)本实验用到的基本仪器除烧杯、天平(砝码、镊子)、玻璃棒外,还有__________
(3)下列情况中,会使所配溶液浓度偏低的是________________。
A.某同学观察液面时仰视 B.没有进行上述的操作步骤D
C.加蒸馏水时,不慎超过了刻度线 D.容量瓶使用前内壁沾有水珠
(4)甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC工作原理如图所示:通入a气体的电极是原电池的_______极(填 “正”或“负”),其电极反应式为__________________________。
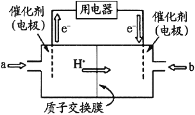
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从粗铜精炼的阳极泥(主要含有Cu2Te)中提取粗碲的一种工艺流程如图:(已知TeO2微溶于水,易溶于强酸和强碱) 下列有关说法正确的是

A. “氧化浸出”时为使碲元素沉淀充分,应加入过量的硫酸
B. “过滤”用到的玻璃仪器:分液漏斗、烧杯、玻璃棒
C. “还原”时发生的离子方程式为2SO32-+Te4++4OH-=Te↓+2SO42-+2H2O
D. 判断粗碲洗净的方法:取少量最后一次洗涤液,加入BaCl2溶液,没有白色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是以植物细胞中半纤维素木聚糖为原料合成镇痛药品莫沙朵林(G)的路线:
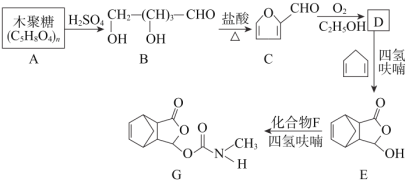
已知:①四氢呋喃(![]() )在流程中作反应的催化剂;
)在流程中作反应的催化剂;
②
③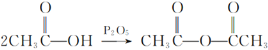
回答下列问题:
(1)B中官能团的名称为______;
(2)E→G的反应类型:______;
(3)D和F的结构简式分别是______、______;
(4)C与新制氢氧化铜反应的化学方程式为:______;
(5)写出同时满足下列条件的E的一种同分异构体的结构简式:______。
①分子中含有苯环②能发生银镜反应③能与FeCl3溶液发生显色反应
(6)有机物H(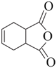 )是合成抗病毒药物阿昔洛韦的中间体。按上述合成路线,写出以1,3-丁二烯为原料制备
)是合成抗病毒药物阿昔洛韦的中间体。按上述合成路线,写出以1,3-丁二烯为原料制备![]() 的合成路线流程图______(无机试剂任选);
的合成路线流程图______(无机试剂任选);
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 常温常压下,8g甲烷中含C-H键数目为0.4NA
B. 标准状况下,11.2LSO3中含分子数目为0.5NA
C. 1L0.1mol/LNH4NO3溶液中含氧原子数目为0.3NA
D. 7.8gNa2O2与足量CO2完全反应转移电子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na5PW11O39Cu/T1O2膜可催化污染物的光降解,一种生产工艺流程如下,回答下列问题:

(1)“溶解I”发生的离子反应方程式为______________,Na2WO4 (钨酸钠)在酸性条件下有较强的氧化性,该步骤不能用浓盐酸代替浓硝酸的原因是____________。
(2)“除杂”时用过量有机溶剂萃取溶液中的NO3-,再通过_________方法分离杂质。
(3)“溶解II”需要加入水、乙醇和稀硫酸。
①加入乙醇的目的是_____________。
②钛酸四丁酯水解产生TiO2和C4H9OH的化学方程式为_____。
③溶液中Cu2+浓度为0.02 mol·L-1,需调节pH小于________。(已知Ksp[Cu(OH)2]=2×10-20)
(4)培烧温度、Na5PW11O39Cu 用量对Na5PW11O39Cu/TiO2膜催化活性的影响随(时间)变化如图1、图2所示:
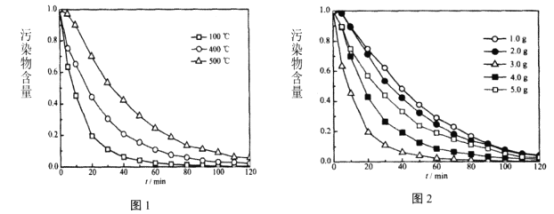
制备Na5PWl1O39Cu/TiO2膜的最佳条件为:培烧温度_____,Na5PW11O39Cu用量_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物的转化过程如图所示。下列分析合理的是

A. 催化剂a表面发生了极性共价键的断裂和形成
B. N2与H2反应生成NH3的原子利用率为100%
C. 在催化剂b表面形成氮氧键时,不涉及电子转移
D. 催化剂a、b能提高反应的平衡转化率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com