
【题目】氯气是一种重要的工业原料。
(1)写出实验室制取氯气反应的化学方程式________________________。
(2)资料显示:Ca(ClO)2 +CaCl2+2H2SO4![]() 2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
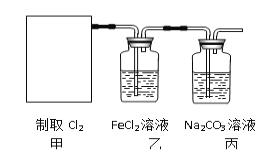
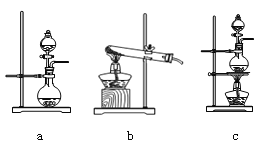
①在该实验中,甲部分的装置是_______(填字母)。
②乙装置中FeCl2溶液与Cl2反应的离子方程式是________________。
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质,这种物质是_______(化学式)。
④有人认为该实验存在明显的缺陷,如何改进:______________
请你写出Cl2和“④”中“最合适的化学试剂”反应的离子方程式______________。
【答案】MnO2 + 4HCl(浓)![]() MnCl2 + Cl2↑+ 2H2O c 2Fe2++Cl2 = 2Fe3++2Cl- NaClO 增加尾气处理装置 Cl2+2OH-=Cl-+ClO-+H2O
MnCl2 + Cl2↑+ 2H2O c 2Fe2++Cl2 = 2Fe3++2Cl- NaClO 增加尾气处理装置 Cl2+2OH-=Cl-+ClO-+H2O
【解析】
(1)实验室利用二氧化锰在加热的条件下氧化浓盐酸制备氯气;
(2)①根据实验原理分析制备氯气的实验装置;
②氯气和氯化亚铁反应生成氯化铁,据此书写;
③氯气和碳酸钠溶液反应生成的次氯酸具有漂白性,据此判断;
④根据氯气具有毒性,能与氢氧化钠溶液反应分析。
(1)实验室利用二氧化锰在加热的条件下氧化浓盐酸制备氯气,则实验室制取氯气反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2 +Cl2↑+2H2O。
MnCl2 +Cl2↑+2H2O。
(2)①根据反应Ca(ClO)2+CaCl2+2H2SO4![]() 2CaSO4+2Cl2↑+2H2O可知制备氯气属于液体和液体反应且需要加热,因此选择c装置,答案选c;
2CaSO4+2Cl2↑+2H2O可知制备氯气属于液体和液体反应且需要加热,因此选择c装置,答案选c;
②Fe2+具有还原性,氯气具有强氧化性,把Fe2+氧化成Fe3+,反应的离子反应方程式为2Fe2++Cl2=2Fe3++2Cl-;
③Cl2+H2O=HCl+HClO,HCl+Na2CO3=NaHCO3+NaCl,HClO+Na2CO3=NaClO+NaHCO3,次氯酸钠具有强氧化性,因此可制得某种生活中常用的漂白、消毒的物质,该物质的化学式为NaClO;
④氯气有毒,缺少尾气处理装置,处理氯气常用NaOH,发生反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。


科目:高中化学 来源: 题型:
【题目】用间接电化学法可对大气污染物NO进行无害化处理,其工作原理如图所示,质子膜允许H+和H2O通过。下列说法正确的是
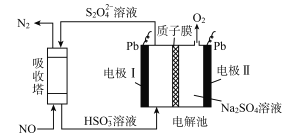
A. 电极I为阴极,电极反应式为2H2O+2e-=2OH-+H2↑
B. 电解时H+由电极I向电极II迁移
C. 吸收塔中的反应为2NO+2S2O42-+2H2O=N2+4HSO3-
D. 每处理1molNO,可同时得到32gO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如下装置处理含KMnO4的废液,使Mn元素转化为MnO2沉淀,从而消除重金属污染,下列说法错误的是
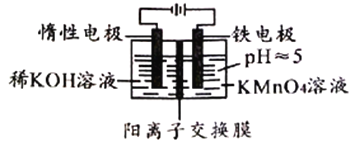
A. MnO4-处理完全后,实验结束时左侧可能会生成沉淀
B. 右侧产生的Fe2+沉淀MnO4-的离子方程式为:7H2O+3Fe2++MnO4-=3Fe(OH)3↓+MnO2↓+5H+
C. 当电路中转移6mole-时,可以产生87gMnO2沉淀
D. 为了增大右侧溶液的导电性可以加稀硫酸造成强酸性环境
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子化合物M(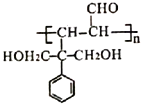 )和高分子化合物J用途广泛。其合成路线如下图所示:
)和高分子化合物J用途广泛。其合成路线如下图所示:
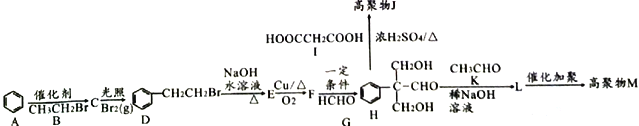
已知:①![]()
②CH3CHO+HCHO![]() HOH2C-CH2-CHO
HOH2C-CH2-CHO
③CH3CHO+HCHO![]() CH2=CH-CHO+H2O
CH2=CH-CHO+H2O
回答下列问题:
(1)有机物C的名称是___________________。
(2)D到E和E到F的反应类型分别是__________________、______________________。
(3)有机物L的结构简式为______________________。
(4)控制反应条件保证H中醛基不被氧化,H与I发生缩聚反应得到高聚物J的化学方程式为___________________________________________。
(5)有机物F的催化氧化产物满足下列条件的同分异构体有_______种;其中核磁共振氢谱有4组峰的结构简式为____________________;
①含有苯环 ②能够发生银镜反应 ③与FeCl3溶液不发生显色反应
(6)根据本题的条件设计用![]() 、CH3Cl、CH3CH2CHO合成
、CH3Cl、CH3CH2CHO合成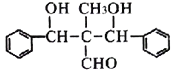 的路线。___________________
的路线。___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是向MgCl2和AlCl3的混合溶液中加入NaOH溶液和盐酸时沉淀的物质的量y mol与加入NaOH溶液和盐酸的体积x mL的关系图,根据图示判断,下列结论中不正确的是

A. N点时溶液中的溶质只有NaCl
B. 原混合溶液中c (MgCl2)∶c (AlCl3)=1∶2
C. c (NaOH)=c (HCl)
D. M点之前加入的是NaOH溶液,M点之后加入的是盐酸
【答案】B
【解析】由图象可知N→M发生Al(OH)3+OH-===AlO2-+2H2O,设氢氧化钠溶液浓度为c,则消耗氢氧化钠0.01cmol,n[Al(OH)3]=n(AlCl3)=0.01cmol;ON消耗氢氧化钠0.05cmol,分别发生MgCl2+2NaOH=Mg(OH)2↓+2NaCl、AlCl3+3NaOH=Al(OH)3↓+3NaCl,可知n(MgCl2)=(0.05cmol-0.01c×3mol)/2=0.01cmol,则c(AlCl3):c(MgCl2)=1:1,M点时溶液成分为NaAlO2,之后继续加入溶液后沉淀质量逐渐增大,此时应加入盐酸,发生反应为:NaAlO2+HCl+H2O= Al(OH)3↓+NaCl,继续加入盐酸沉淀逐渐溶解,生成氯化镁、氯化铝和氯化钠,则消耗的氢氧化钠和HCl的物质的量相等,A.根据分析可知,N点时溶液中的溶质只有NaCl,A正确;B.原混合溶液中c(MgCl2):c(AlCl3)=1:1,B错误;C.由横坐标可知消耗盐酸和氢氧化钠的体积相同,则二者物质的量浓度相同,C正确;D.根据分析可知,M点之前加入的是NaOH溶液,M点之后加入的是盐酸,D正确;答案选B。
【题型】单选题
【结束】
16
【题目】证明某溶液中只含有Fe2+而不含有Fe3+的实验方法是
①先滴加氯水,再滴加KSCN溶液后显红色
②先滴加KSCN溶液,不显红色,再滴加氯水后显红色
③滴加NaOH溶液,先产生白色沉淀,后变灰绿,最后呈红褐色
④只需滴加KSCN溶液
A. ①② B. ②③ C. ③④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级四氧化三铁是应用最为广泛的软磁性材料之一。共沉淀法是目前制备纳米四氧化三铁的重要方法,其流程如图示:
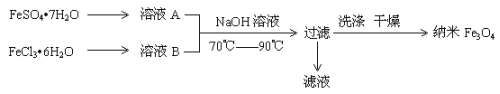
下列说法不正确的是
A.保存溶液A时,应加入少量铁粉
B.其制备反应类型不属于氧化还原反应
C.取滤液进行焰色反应,火焰为黄色
D.FeSO4·7H2O 和 FeCl3·6H2O的物质的量之比最好应为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学做如下实验:
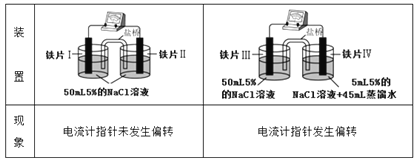
已知K3[Fe(CN)6]遇Fe2+生成深蓝色沉淀,则下列说法正确的是
A. “电流计指针未发生偏转”,说明铁片I、铁片II均未被腐蚀
B. 用K3[Fe(CN)6]溶液检验铁片III、IV附近溶液,可判断电池的正、负极
C. 铁片I、III所处的电解质溶液浓度相同,二者的腐蚀速率相等
D. 铁片IV的电极反应式为Fe-3e-=Fe3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com