
����Ŀ��A��I�ֱ��ʾ��ѧ��ѧ�г�����һ�����ʣ�����֮�����ϵ��ͼ��ʾ(���ַ�Ӧ�������û���г�)����֪HΪ��̬�����F�Ǻ��ɫ������ˮ�ij�������A��B��C��D��E��F���������о���ͬһ��Ԫ�ء�

����д���пհף�
��1��A��B��C��D��E��F����������������ͬһ��Ԫ�ص�������___��
��2����Ӧ�ٵĻ�ѧ����ʽΪ___��
��3����Ӧ�۵����ӷ���ʽΪ___��
��4����Ӧ��Ļ�ѧ����ʽΪ___��
��5����Ӧ�����е�������____��
��6��1molI������Ӧ�����ɵ�A��������������ˮ������Ӧ�����ɵ����廻��ɱ�״����ռ___L��
���𰸡���Ԫ�� 8Al��3Fe3O4![]() 4Al2O3��9Fe Fe3O4+8H+=2Fe3++Fe2++4H2O Al2O3��2NaOH=2NaAlO2��H2O ���ɵİ�ɫ�����ڿ�����Ѹ�ٱ�ɻ���ɫ������ɺ��ɫ 33.6
4Al2O3��9Fe Fe3O4+8H+=2Fe3++Fe2++4H2O Al2O3��2NaOH=2NaAlO2��H2O ���ɵİ�ɫ�����ڿ�����Ѹ�ٱ�ɻ���ɫ������ɺ��ɫ 33.6
��������
F�Ǻ��ɫ������ˮ�ij�������FΪ����������E���ڿ�����ת��ΪF����E��C���������Ʒ�Ӧ���ɣ���EΪ������������CΪ�Ȼ�������B�������ᷴӦ�����Ȼ�������D����BΪ������������DΪ�Ȼ�����A�ڿ�����ȼ���ܹ�������������������AΪ�����ʣ�������������I�ڸ��������·�Ӧ���������ʣ�I�������������Ʒ�Ӧ����֪IΪ�����ʣ��������������ڸ��������·������ȷ�Ӧ������HΪ�������������������������������Ʒ�Ӧ����G����GΪƫ�����ơ�
��1��AΪ����BΪ������������CΪ�Ȼ�������DΪ�Ȼ�����E������������FΪ���������������������ж�������Ԫ�أ��ʴ�Ϊ����Ԫ�أ�
��2���������������������������ȷ�Ӧ���䷴Ӧ�ķ���ʽΪ8Al��3Fe3O4![]() 4Al2O3��9Fe���ʴ�Ϊ��8Al��3Fe3O4
4Al2O3��9Fe���ʴ�Ϊ��8Al��3Fe3O4![]() 4Al2O3��9Fe��
4Al2O3��9Fe��
��3���������������������ᷴӦ���䷴Ӧ�����ӷ���ʽΪFe3O4+8H+=2Fe3++Fe2++4H2O���ʴ�Ϊ��Fe3O4+8H+=2Fe3++Fe2++4H2O��
��4���������������������Ʒ�����Ӧ����Ӧ�Ļ�ѧ����ʽΪAl2O3��2NaOH=2NaAlO2��H2O���ʴ�Ϊ��Al2O3��2NaOH=2NaAlO2��H2O��
��5���������������ڿ�����ת��Ϊ����������������Ϊ���ɵİ�ɫ�����ڿ�����Ѹ�ٱ�ɻ���ɫ������ɺ��ɫ���ʴ�Ϊ�����ɵİ�ɫ�����ڿ�����Ѹ�ٱ�ɻ���ɫ������ɺ��ɫ��
��6��1mol����������������Ӧ�����������������������ɵ�����������ˮ������Ӧ�������������ݵ�ʧ�����غ��֪����ʧȥ�ĵ������������������õ��ĵ�����������ʽ1��3=2��n��H2��,��n��H2��=1.5mol�����״���£����������V��H2��=1.5mol��22.4L/mol=33.6L���ʴ�Ϊ33.6��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��װ�ý�����Ӧʵ�飬�ܴﵽʵ��Ŀ�ĵ���

A.��ͼ1��ʾװ�ó�ȥCl2�к��е�����HCl
B.��ͼ2��ʾװ������NH4Cl������Һ�Ʊ�NH4Cl����
C.��ͼ3��ʾװ����ȡ����������CO2����
D.��ͼ4��ʾװ�÷���CCl4��ȡ��ˮ���ѷֲ���л����ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������20mL 0.1mol/L��ˮ��ͨ��HCl���壬��Һ����ˮ�������������Ũ����ͨ��HCl���������仯��ͼ��ʾ��������˵����ȷ����
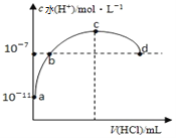
A. b��ͨ���HCl���壬�ڱ����Ϊ44.8mL
B. b��c֮����Һ��c(NH4+)>c(Cl-)
C. ȡ10mL��c����Һϡ��ʱ��c(NH4+)/c(NH3��H2O)��С
D. d����Һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ԭ��Ӧ�ĵ���ת����Ŀ�ͷ���д��������
��1��2K2S + K2SO3 + 3H2SO4= 3K2SO4 + 3S��+ 3H2O _______������_______
��2��2KMnO4 ��5H2O2 + 3H2SO4 = K2SO4��2MnSO4��5O2�� �� 8H2O _______ ������_______
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ���庬��ԼΪ 65 mg��L-1,�Ӻ�ˮ����ȡ��Ĺ�����������:

(1)���ϲ�������ѻ������̬���壬������ֽ�֮ת��ɻ���̬���壬��Ŀ����____________��
(2)�����ͨ���ȿ�������Br2�����������____��
A.������ ��B.��ԭ�ԡ� C.�ӷ��� D.��ʴ��
(3)��������漰�����ӷ�Ӧ����,�������淽���������ʵ��Ļ�ѧ������:_____![]()
(4)���������д�������������Ҳ�����ö�������ˮ��Һ���գ�������������������д�������������ˮ��Һ��Ӧ�Ļ�ѧ����ʽ:__________��
(5)ʵ���ҷ����廹�������ܼ���ȡ��,���п������������ȡ������____��
A.�Ҵ� B.���Ȼ�̼����C.�ռ���Һ D.��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס��ҡ�����ȡ300mLͬŨ�ȵ����ᣬ���벻ͬ������ͬһþ���Ͻ��ĩ��������ʵ�飬�й������б����£�
ʵ����� | �� | �� | �� |
�Ͻ�����/mg | 510 | 765 | 918 |
(��״��)�������/mL | 560 | 672 | 672 |
��1����������ʵ���Ũ���Ƕ���___��
��2���Ͻ���þ���������������Ƕ���___��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС���ͬѧ��һ�������Ba(OH)2��Һ����μ���ϡ���ᣬ����û��Һ�ĵ���������ʱ��仯������ͼ����С��ͬѧ��ͼ�����������

A.AB����Һ�ĵ����������ϼ�����˵���������ת��Ϊ�ǵ����
B.B���ĵ�������Ϊ0��˵����Һ�м���û�������ƶ�������
C.BC����Һ�ĵ�����������������Ҫ�����ڹ�����Ba(OH)2����������ӵ���
D.aʱ��Ba(OH)2��Һ����ϡ����ǡ����ȫ�к�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ���������ʵ���Ũ�ȹ�ϵ��ȷ����
A. 25 ��ʱ����0.1 mol��L��1 NH4HSO4��Һ�еμ�NaOH��Һ�����ԣ�c(Na��)>c(NH)>c(SO![]() )>c(OH��)��c(H��)
)>c(OH��)��c(H��)
B. 25 ��ʱ��NaB��Һ��pH��8��c(Na��)-c(B��)��9.9��10��7 mol��L��1
C. 0.1![]()
![]() ��Һ��
��Һ��![]()
D. ��ͬ���ʵ���Ũ�ȵ�CH3COONa��NaClO�Ļ��Һ�У�������Ũ�ȵĴ�С��ϵ�ǣ�c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������A�ǻ����л�����ԭ�ϣ���A�ϳɸ߷��ӻ�����C��![]() �ĺϳ�·������ͼ�����ַ�Ӧ������ȥ����
�ĺϳ�·������ͼ�����ַ�Ӧ������ȥ����

��֪����R��CN![]() R��COOH
R��COOH
��![]()
�ش��������⣺
(1)A�Ļ�ѧ������____________��
(2)C���������������ŵ�������____________��D�Ľṹ��ʽ��____________��
(3)B![]() C��G
C��G![]() H�ķ�Ӧ���ͷֱ���____________��____________��
H�ķ�Ӧ���ͷֱ���____________��____________��
(4)A![]() E�Ļ�ѧ����ʽ��_________________________________________��
E�Ļ�ѧ����ʽ��_________________________________________��
(5)F![]() G�Ļ�ѧ����ʽ��_________________________________________��
G�Ļ�ѧ����ʽ��_________________________________________��
(6)B��ͬ���칹���У���B������ͬ�Ĺ��������ܷ���������Ӧ�Ĺ���________�֣����������칹��������ij��ͬ���칹��M��H2�ӳɵIJ��C5H10O2���ĺ˴Ź���������4��壬�ҷ������Ϊ6��2��1��1����M�Ľṹ��ʽ��______________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com