
【题目】在一密闭容器中加入A和B,各物质的物质的量浓度随着反应的进行,如图所示。下列说法不正确的是

A.该反应的化学方程式为5A+4B![]() 4C
4C
B.2min时,该反应达到平衡,此时A、B、C的浓度比为5:4:4
C.用B的浓度变化表示0-2min时间内的速率为2mol/(L·min)
D.2min前,正反应速率逐渐减小,逆反应速率逐渐增大,但是正反应速率大于逆反应速率。
【答案】B
【解析】
A、根据图象可知,反应进行到2min时,物质的浓度不在发生变化,说明反应达到平衡状态,其中AB的浓度减小,C的浓度最大,其浓度的变化量分别是6mol/L-1mol/L=5mol/L、7mol/L-3mol/L=4mol/L、4mol/L-0=4mol/L,反应物生成物浓度之比等于物质的量之比,等于化学方程式计量数之比,所以化学方程式为,5A+4B4C,故A正确;
B、2min时,该反应达到平衡,ABC浓度分别为:1mol/L,3mol/L,4mol/L,此时A、B、C的浓度比为1:3:4,故B错误;
C、B的在2min内的浓度变化为4mol/L,反应速率![]() =
=![]() =2min/L,故C正确;
=2min/L,故C正确;
D、2min前由于反应是向正反应方向移动的,反应物浓度减小,生成物浓度增大,正反应速率逐渐减小,逆反应速率逐渐增大,正反应速率大于逆反应速率,故D正确;
故选:B。


科目:高中化学 来源: 题型:
【题目】有一种化合物是很多表面涂层的重要成分,其结构如图所示,其中W、X、Y、Z为原子序数依次增大的短周期主族元素,只有X、Y在同一周期,Y无最高正价,Z的含氧酸均具有氧化性,下列有关说法正确的是( )
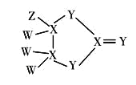
A.WZ沸点高于W2Y的沸点
B.含Z的两种酸反应可制得Z的单质
C.W2Y2中既含离子键又含共价键键
D.X的含氧酸一定为二元弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用HCl滴定NaOH:c(NaOH)=![]() (填“偏大”或“偏小”或“无影响”)。
(填“偏大”或“偏小”或“无影响”)。
(1)酸式滴定管未润洗__________;
(2)碱式滴定管未润洗__________;
(3)锥形瓶用NaOH润洗__________;
(4)锥形瓶洗净后未干燥__________;
(5)酸式滴定管滴定前有气泡,滴定结束后无气泡__________;
(6)滴定时不小心滴到锥形瓶外__________;
(7)振荡锥形瓶时溶液溅出__________;
(8)滴定前仰视,滴定后俯视__________;
(9)滴定前平视,后仰视__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修5:有机化学基础]
利用化学方法合成味精的路线如下图所示:
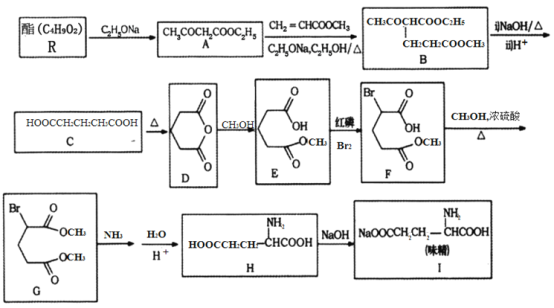
请回答以下问题:
(1)R的结构简式为________;由A生成B的反应类型是________。
(2)F中含氧官能团的名称为________;化合物H的化学名称为________________。
(3)写出由C生成D的化学方程式________________。
(4)写出一种符合下列要求的A的同分异构体的结构简式________。
①结构中含有六元环,光谱测定显示,分子结构中不存在甲基;
②能在NaOH溶液中发生水解反应;
③1mol该物质与足量金属Na反应能够生成0.5mol H2
(5)参照上述合成路线,写出以苯丙酸(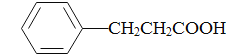 )和甲醇(其它无机试剂任选),设计合成苯丙氨酸(
)和甲醇(其它无机试剂任选),设计合成苯丙氨酸(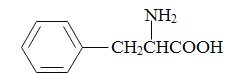 )的路线。_______________________________________________________________________
)的路线。_______________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三种有机物甲、乙、丙,其结构如图所示:

下列有关说法中错误的是
A.甲、乙、丙都是芳香族化合物,只有两种能与碳酸氢钠溶液反应
B.只用碳酸氢钠溶液和银氨溶液能检验甲、乙、丙
C.与足量氢气反应,相同物质的量的甲、乙、丙消耗氢气的物质的量之比为3∶4∶3
D.甲的化学式为C11H14O2,乙含有两种含氧官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应①是制备SiH4的一种方法,利用其副产物可制备相应物质,有关转化关系如下:
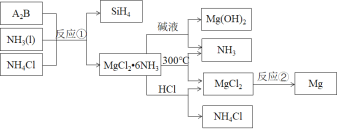
下列说法不正确的是( )
A.A2B的化学式为Mg2Si
B.NH3、NH4Cl可以循环使用
C.反应①中参加反应的NH3和NH4Cl的物质的量之比为1∶1
D.反应②中每生成24gMg转移2mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烧食品中;NH4HSO4在分析试剂、医药、电子工业中用途认识广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是__(用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1mol·L-1NH4Al(SO4)2中c(NH4+)__(填“等于”“大于”或“小于”)0.1mol·L-1NH4HSO4中c(NH4+)。
(3)20℃时,0.1mol·L-1NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=__(表达式)。
(4)室温时,向100mL0.1mol·L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示。
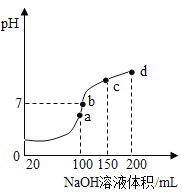
试分析图中a、b、c、d四个点,水的电离程度最大的是___点;在b点,溶液中各离子浓度由大到小的排列顺序是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不法商贩利用“豆浆粉精”勾兑新鲜豆浆被媒体曝光。据悉,这种豆浆完全没有营养价值,“豆浆粉精”中的乙基香兰素(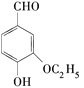 )过量食用还可能导致头痛、恶心、呕吐、呼吸困难,甚至能够损伤肝、肾,对人体有较大的危害。则下列关于乙基香兰素的说法错误的是 ( )
)过量食用还可能导致头痛、恶心、呕吐、呼吸困难,甚至能够损伤肝、肾,对人体有较大的危害。则下列关于乙基香兰素的说法错误的是 ( )
A.乙基香兰素的分子式为C9H10O3
B.乙基香兰素与苯甲醛互为同系物
C.乙基香兰素的同分异构体可能含有酯基
D.乙基香兰素能与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮、氧、氯、钠、铜等元素的化合物广泛存在于自然界,回答下列问题:
(1)基态氯原子的价电子排布图是________________________;基态铜原子核外电子占有的空间运动状态有____________种
(2)碳、氮、氧三种元素中第一电离能最大的是____________ (填元素符号)CO32-中碳原子的杂化轨道类型为____________。
(3)相同条件下,水的沸点高于液氨,原因是________________________。
(4)铜与CNˉ可形成络合离子[Cu(CNˉ)4]2-,写出一种与CNˉ互为等电子体的分子的化学式____________;1 mol[ Cu(CNˉ)4]2-中含有____________molσ键;若将[Cu(CNˉ)4]2-中二个CNˉ换为Clˉ,只有一种结构,则[Cu(CNˉ)4]2-中4个氮原子所处空间位置关系为_________。
(5)氯化钠的晶胞如图所示。晶体中氯离子以面心立方最密堆积排列,钠离子嵌入在氯离子之间的空隙中。一个氯离子周围离氯离子最近的氯离子数目为__________个。已知:半径r(Clˉ)=apm,r(Na+)=bpm。摩尔质量M(NaCI)=cg·mol-1则氯化钠晶体的密度为_________g·cm-3

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com