
ΓΨΧβΡΩΓΩ÷ΊΗθΥαΡΤΥΉ≥ΤΚλΖ·ΡΤ![]() Θ§ «÷Ί“ΣΒΡΜ·ΙΛ≤ζΤΖΚΆ«Ω―θΜ·ΦΝΘ°ΙΛ“Β÷Τ±ΗΚλΖ·ΡΤΒΡΝς≥Χ»γœ¬ΘΚ
Θ§ «÷Ί“ΣΒΡΜ·ΙΛ≤ζΤΖΚΆ«Ω―θΜ·ΦΝΘ°ΙΛ“Β÷Τ±ΗΚλΖ·ΡΤΒΡΝς≥Χ»γœ¬ΘΚ
(1)Μ·―ß…œΩ…ΫΪΡ≥–©―Έ–¥≥…―θΜ·ΈοΒΡ–Έ ΫΘ§»γ![]() Ω…–¥≥…
Ω…–¥≥…![]() Θ§‘ρ
Θ§‘ρ![]() Ω…–¥≥…______Θ°
Ω…–¥≥…______Θ°
(2)λ―…’ΗθΧζΩσ ±Θ§Ωσ ·÷–Ρ―»ήΒΡ![]() …ζ≥…Ω…»ή”ΎΥ°ΒΡ
…ζ≥…Ω…»ή”ΎΥ°ΒΡ![]() Θ§Ζ¥”ΠΜ·―ßΖΫ≥Χ Ϋ»γœ¬ΘΚ
Θ§Ζ¥”ΠΜ·―ßΖΫ≥Χ Ϋ»γœ¬ΘΚ![]() ΈΣΝΥΦ”ΩλΗΟΖ¥”ΠΒΡΖ¥”ΠΥΌ¬ Θ§Ω…≤…»ΓΒΡ¥κ © «______
ΈΣΝΥΦ”ΩλΗΟΖ¥”ΠΒΡΖ¥”ΠΥΌ¬ Θ§Ω…≤…»ΓΒΡ¥κ © «______![]() –¥“Μ÷÷Φ¥Ω…
–¥“Μ÷÷Φ¥Ω…![]()
(3)“―÷Σ![]() ‘Ύ≤ΜΆ§ΒΡΥα–‘»ή“Κ÷–”–≤ΜΆ§ΒΡΖ¥”ΠΘ§»γΘΚ
‘Ύ≤ΜΆ§ΒΡΥα–‘»ή“Κ÷–”–≤ΜΆ§ΒΡΖ¥”ΠΘ§»γΘΚ
![]() ΘΜ
ΘΜ![]()
ΔΌΆυΜλΚœ»ή“ΚΦΉ÷–Φ”»κΝρΥα±Ί–κ ΝΩΒΡ‘≠“ρ «______Θ°
ΔΎΜλΚœ»ή“Κ““÷–»ή÷ ΒΡΜ·―ß Ϋ «______Θ°
(4)‘ΎΚ§![]() ΖœΥ°÷–¥φ‘ΎΉ≈ΤΫΚβΘΚ
ΖœΥ°÷–¥φ‘ΎΉ≈ΤΫΚβΘΚ![]() Θ§«κ–¥≥ωΗΟΤΫΚβΒΡΤΫΚβ≥Θ ΐ±μ¥ο Ϋ
Θ§«κ–¥≥ωΗΟΤΫΚβΒΡΤΫΚβ≥Θ ΐ±μ¥ο Ϋ![]() ______Θ§»τΦΧ–χΦ”Υ°œΓ ΆΘ§ΤΫΚβΫΪ______“ΤΕ·
______Θ§»τΦΧ–χΦ”Υ°œΓ ΆΘ§ΤΫΚβΫΪ______“ΤΕ·![]() ΧνΓΑ’ΐœρΓ±ΓΔΓΑΡφœρΓ±ΓΑ≤ΜΓ±
ΧνΓΑ’ΐœρΓ±ΓΔΓΑΡφœρΓ±ΓΑ≤ΜΓ±![]() Θ°
Θ°
(5)«κ≈δΤΫΦν–‘»ή“ΚΜΙ‘≠Ζ®÷–ΖΔ…ζΒΡάκΉ”Ζ¥”ΠΘΚ
______![]() ___
___![]() ______
______![]() --______
--______![]() ______
______![]() ______
______![]() Θ°
Θ°
ΓΨ¥πΑΗΓΩ![]() ΖέΥιΩσ ·ΓΔ…ΐΗΏΈ¬Ε» …ΌΝΩ≤ΜΡή≥ΐΨΓ
ΖέΥιΩσ ·ΓΔ…ΐΗΏΈ¬Ε» …ΌΝΩ≤ΜΡή≥ΐΨΓ![]() Β»‘”÷ Θ§ΙΐΝΩΜα…ζ≥…
Β»‘”÷ Θ§ΙΐΝΩΜα…ζ≥…![]() Β»Η±≤ζΈο
Β»Η±≤ζΈο ![]() ΚΆ
ΚΆ![]()
![]() ’ΐœρ 4 6 19 8 3 14
’ΐœρ 4 6 19 8 3 14
ΓΨΫβΈωΓΩ
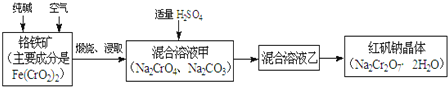
ΗθΧζΩσΦ”»κ¥ΩΦνΘ§Ά®»κΩ’Τχλ―…’Θ§Ψ≠Ϋΰ»ΓΚσΒΟΒΫNa2CrO4ΓΔNa2CO3Θ§Φ”»κ ΝΩΝρΥαΘ§ΒΟΒΫΜλΚœ»ή“Κ““Κ§”–Na2Cr2O7ΚΆNa2SO4Θ§»ΜΚσΫαΨßΩ…ΒΟΒΫNa2Cr2O7ΨßΧεΘ§
Θ®1Θ©άύ±»Na2SiO3Ω…–¥≥…Na2OSiO2Άξ≥…FeΘ®CrO2Θ©2ΒΡ―θΜ·ΈοΒΡ–Έ ΫΘΜ
Θ®2Θ©ΗυΨί”ΑœλΜ·―ßΖ¥”ΠΥΌ¬ ΒΡ“ρΥΊΖ÷ΈωΘΜ
Θ®3Θ©ΔΌΙΧΧεΆΦ ΨΦΑΧβ÷––≈œΔΩ…÷ΣΘ§…ΌΝΩ≤ΜΡή≥ΐΨΓNa2CO3Β»‘”÷ Θ§ΙΐΝΩΜα…ζ≥…Na2Cr3O10Β»Η±≤ζΈοΘΜ
ΔΎΖΔ…ζΝΥΖ¥”Π2CrO42-+2H+=Cr2O72-+H2OΘ§…ζ≥…ΝΥNa2Cr2O7ΚΆNa2SO4ΘΜ
Θ®4Θ©Μ·―ßΤΫΚβ≥Θ ΐΘ§ «÷Η‘Ύ“ΜΕ®Έ¬Ε»œ¬Θ§Ω…ΡφΖ¥”Π¥οΒΫΤΫΚβ ±Ης…ζ≥…Έο≈®Ε»ΒΡΜ·―ßΦΤΝΩ ΐ¥ΈΟίΒΡ≥ΥΜΐ≥ΐ“‘ΗςΖ¥”ΠΈο≈®Ε»ΒΡΜ·―ßΦΤΝΩ ΐ¥ΈΟίΒΡ≥ΥΜΐΥυΒΟΒΡ±»÷ΒΘ§Υ°≤Μ–η“Σ–¥≥ωΘ§Φ”Υ°¥ΌΫχΤΫΚβ’ΐœρ“ΤΕ·ΘΜ
Θ®5Θ©Cr2O72-ΓζCr3+Θ§S2-ΓζS2O32-Θ§ΗυΨίΒγΉ”ΉΣ“Τ ΊΚψ≈δΤΫΓΘ
ΗθΧζΩσΦ”»κ¥ΩΦνΘ§Ά®»κΩ’Τχλ―…’Θ§Ψ≠Ϋΰ»ΓΚσΒΟΒΫNa2CrO4ΓΔNa2CO3Θ§Φ”»κ ΝΩΝρΥαΘ§ΒΟΒΫΜλΚœ»ή“Κ““Κ§”–Na2Cr2O7ΚΆNa2SO4Θ§»ΜΚσΫαΨßΩ…ΒΟΒΫNa2Cr2O7ΨßΧεΘ§
(1)Fe(CrO2)2÷–Χζ‘ΣΥΊΜ·ΚœΦέ «+2ΦέΘ§―θΜ·ΈοΈΣFeOΘ§Ηθ‘ΣΥΊΜ·ΚœΦέ+3ΦέΘ§―θΜ·ΈοΈΣCr2O3Θ§Υυ“‘Fe(CrO2)2–¥≥…―θΜ·Έο–Έ ΫΈΣFeOCr2O3Θ§Ι ¥πΑΗΈΣΘΚFeOCr2O3ΘΜ
(2)‘ω¥σΖ¥”ΠΈοΫ”¥ΞΟφΜΐΩ…“‘Φ”ΩλΖ¥”ΠΥΌ¬ Θ§…ΐΗΏΈ¬Ε»Ω…“‘¥σ¥σΦ”ΩλΖ¥”ΠΥΌ¬ Θ§Ι ¥πΑΗΈΣΘΚΖέΥιΩσ ·ΓΔ…ΐΗΏΈ¬Ε»ΘΜ
(3)ΔΌ”…”Ύ…ΌΝΩΡ―“‘≥ΐΨΓΧΦΥαΡΤΘ§ΙΐΝΩΜαΖΔ…ζΖ¥”Π3CrO42+4H+=Cr3O102+2H2OΘ§…ζ≥…ΝΥNa2Cr3O10Β»Η±≤ζΈοΘ§Υυ“‘±Ί–κΦ”»κ ΝΩΝρΥαΘ§Ι ¥πΑΗΈΣΘΚ…ΌΝΩ≤ΜΡή≥ΐΨΓ![]() Β»‘”÷ Θ§ΙΐΝΩΜα…ζ≥…
Β»‘”÷ Θ§ΙΐΝΩΜα…ζ≥…![]() Β»Η±≤ζΈοΘΜ
Β»Η±≤ζΈοΘΜ
ΔΎ”…”ΎΖΔ…ζΝΥΖ¥”Π2CrO42+2H+=Cr2O72+H2OΘ§…ζ≥…ΝΥ![]() ΚΆ
ΚΆ![]() Θ§Υυ“‘““÷–»ή÷ ΒΡΜ·―ß Ϋ
Θ§Υυ“‘““÷–»ή÷ ΒΡΜ·―ß Ϋ![]() ΚΆ
ΚΆ![]() Θ§Ι ¥πΑΗΈΣΘΚ
Θ§Ι ¥πΑΗΈΣΘΚ![]() ΚΆ
ΚΆ![]() ΘΜ
ΘΜ
(4)ΗυΨίΜ·―ßΤΫΚβ≥Θ ΐΒΡΕ®“εΘ§Ω…÷ΣCr2O72(aq)+H2O(l)2CrO42(aq)+2H+(aq)ΒΡΤΫΚβ≥Θ ΐK=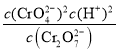 Θ§Φ”Υ°œΓ ΆΘ§¥ΌΫχΥ°ΫβΘ§ΤΫΚβ’ΐœρ“ΤΕ·Θ§Ι ¥πΑΗΈΣΘΚ
Θ§Φ”Υ°œΓ ΆΘ§¥ΌΫχΥ°ΫβΘ§ΤΫΚβ’ΐœρ“ΤΕ·Θ§Ι ¥πΑΗΈΣΘΚ ΘΜ’ΐœρΘΜ
ΘΜ’ΐœρΘΜ
(5) Cr2O72ΓζCr3+Θ§1mol Cr2O72ΜώΒΟΒγΉ”Έο÷ ΒΡΝΩΈΣ1molΓΝ2ΓΝ(63)=6molΘ§S2ΓζS2O32Θ§2molS2 ß»ΞΒγΉ”Έο÷ ΒΡΝΩΈΣ1molΓΝ2ΓΝ[2(2)]=8molΘ§ΗυΨίΒγΉ”ΉΣ“Τ ΊΚψΘ§Ήν–ΓΙΪ±Ε ΐΈΣ24Θ§Υυ“‘ΖΔ…ζΒΡάκΉ”Ζ¥”ΠΈΣΘΚ4Cr2O72+6S2+19H2O®T8Cr(OH)3Γΐ+3S2O32+14OHΘ§Ι ¥πΑΗΈΣΘΚ4ΓΔ6ΓΔ19ΓΔ8ΓΔ3ΓΔ14ΓΘ



| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ–¬–ΆΫβ»»’ρΆ¥ΩΙ―Ή“©ΤΥ―ΉΆ¥ΒΡΫαΙΙ»γΆΦΥυ ΨΘ§œ¬Ν–ΙΊ”ΎΤΥ―ΉΆ¥ΒΡ–π ω’ΐ»ΖΒΡ «
A.ΗΟΈο÷ ΒΡΖ÷Ή” ΫΈΣ![]()
B.ΗΟΈο÷ ΒΡΚΥ¥≈Ι≤’ώ«βΤΉ…œΙ≤”–9ΗωΖε
C.ΗΟΈο÷ ”κ≈®δεΥ°Ζ¥”Π…ζ≥…ΑΉ…Ϊ≥ΝΒμ
D.ΗΟΈο÷ ‘ΎΥα–‘ΧθΦΰœ¬Υ°ΫβΉν÷’Ω…“‘ΒΟΒΫ4÷÷Έο÷
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ≥ΘΈ¬œ¬Θ§Na2CO3ΚΆNaHCO3ΒΡΜλΚœ»ή“Κ÷–c(![]() )ΓΔc(
)ΓΔc(![]() )”κpHΒΡΙΊœΒ»γΆΦΥυ Ψ[ΦΌ…ηc(Na2CO3)+c(NaHCO3)=0.100 molΓΛL-1]ΓΘœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «Θ® Θ©
)”κpHΒΡΙΊœΒ»γΆΦΥυ Ψ[ΦΌ…ηc(Na2CO3)+c(NaHCO3)=0.100 molΓΛL-1]ΓΘœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «Θ® Θ©

A.ΆΦ÷–EΒψ»ή“Κ±μ Ψ≈®Ε»ΨυΈΣ0.05 molΓΛL-1ΒΡNa2CO3ΚΆNaHCO3»ή“ΚΜλΚœΚσΥυΒΟΒΫΒΡ»ή“Κ
B.pH=10ΒΡ»ή“Κ÷–:c(H+)+c(Na+)+c(H2CO3)=c(OH-)+c(![]() )
)
C.pH=11ΒΡ»ή“Κ÷–:c(![]() )<c(
)<c(![]() )
)
D.œρEΒψ»ή“Κ÷–Φ”»κΒ»ΧεΜΐ0.100 molΓΛL-1ΒΡNaOH»ή“ΚΘ§c(![]() )”κc(
)”κc(![]() )÷°ΚΆ±Θ≥÷≤Μ±δ
)÷°ΚΆ±Θ≥÷≤Μ±δ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ“‘±ΫΚΆ““»≤ΈΣ‘≠ΝœΚœ≥…Μ·ΙΛ‘≠ΝœEΒΡ¬ΖœΏ»γœ¬ΘΚ

ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
(1)“‘œ¬”–ΙΊ±ΫΚΆ““»≤ΒΡ»œ Ε’ΐ»ΖΒΡ « ______
![]() ±ΫΚΆ““»≤ΕΦΡή ΙδεΥ°Ά …ΪΘ§«Α’ΏΈΣΜ·―ß±δΜ·Θ§Κσ’ΏΈΣΈοάμ±δΜ·
±ΫΚΆ““»≤ΕΦΡή ΙδεΥ°Ά …ΪΘ§«Α’ΏΈΣΜ·―ß±δΜ·Θ§Κσ’ΏΈΣΈοάμ±δΜ·
![]() ±ΫΚΆ““»≤‘ΎΩ’Τχ÷–»Φ…’ΕΦ”–≈®―Χ≤ζ…ζ
±ΫΚΆ““»≤‘ΎΩ’Τχ÷–»Φ…’ΕΦ”–≈®―Χ≤ζ…ζ
![]() ±Ϋ”κ≈®œθΥαΜλΚœΘ§Υ°‘ΓΦ”»»55ΓΪ60ΓφΘ§…ζ≥…œθΜυ±Ϋ
±Ϋ”κ≈®œθΥαΜλΚœΘ§Υ°‘ΓΦ”»»55ΓΪ60ΓφΘ§…ζ≥…œθΜυ±Ϋ
![]() Ψέ““»≤ «“Μ÷÷”–ΒΦΒγΧΊ–‘ΒΡΗΏΖ÷Ή”Μ·ΚœΈο
Ψέ““»≤ «“Μ÷÷”–ΒΦΒγΧΊ–‘ΒΡΗΏΖ÷Ή”Μ·ΚœΈο
(2)AΒΡΟϊ≥Τ ______ΓΘ
(3)…ζ≥…BΒΡΜ·―ßΖΫ≥Χ ΫΈΣ ______Θ§Ζ¥”Πάύ–Ά « ______ΓΘ
(4)CΒΡΫαΙΙΦρ ΫΈΣ ______ Θ§CΒΡΖ÷Ή”÷–“ΜΕ®Ι≤ΟφΒΡΧΦ‘≠Ή”ΉνΕύ”– ______ ΗωΓΘ
(5)”κDΆ§άύ±π«“”–ΕΰΗωΝυ‘ΣΜΖΫαΙΙ(ΜΖ”κΜΖ÷°Φδ”ΟΒΞΦϋΝ§Ϋ”)ΒΡΆ§Ζ÷“λΙΙΧε”–______÷÷Θ§«κ»Έ–¥ΝΫ÷÷Ά§Ζ÷“λΙΙΧεΒΡΫαΙΙΦρ ΫΘΚ______ΓΘ
(6)≤Έ’’…œ ωΚœ≥…¬ΖœΏΘ§…ηΦΤ“ΜΧθ“‘““»≤ΚΆ±Ί“Σ ‘ΦΝΚœ≥…ΜΖ±ϊΆιΒΡ¬ΖœΏΘΚ ______ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩEΨΏ”–ΙϊœψΈΕΘ§”…≥ΘΦϊ”–ΜζΈοΚœ≥…EΒΡ¬ΖœΏ»γΆΦΘ§«κΜΊ¥πΘΚ

(1)Ζ¥”ΠΔΌΒΡΖ¥”Πάύ–Ά_______Θ§CΒΡΟϊ≥Τ________Θ§F÷–Κ§―θΙΌΡήΆ≈Οϊ≥Τ________ΘΜ
(2)Φλ―ιΈο÷ FΥυ”ΟΒΡ ‘ΦΝΈΣ_____ΓΘCΉΣΜ·ΈΣDΥυ”ΟΒΡ ‘ΦΝΩ…“‘ «__________ΓΘ
(3)œ¬Ν–ΙΊ”ΎΈο÷ BΒΡΥΒΖ®’ΐ»ΖΒΡ «________ΓΘ
AΘ°BΈΣ±ΫΒΡΆ§œΒΈο
BΘ°≥ΘΈ¬≥Θ―Ιœ¬Έο÷ B≥ ΤχΧ§
CΘ°“ΜΕ®ΧθΦΰœ¬Θ§1 mol BΉνΕύΡή”κ4 mol H2ΖΔ…ζΦ”≥…
DΘ°BΦ»Ρή ΙKMnO4»ή“ΚΆ …Ϊ”÷Ρή ΙBr2/CCl4 »ή“ΚΆ …Ϊ
(4) E‘Ύ«β―θΜ·ΡΤ»ή“Κ÷–Υ°ΫβΒΡΜ·―ßΖΫ≥Χ Ϋ «___________________________________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ≥τ―θ «άμœκΒΡ―ΧΤχΆ―œθ ‘ΦΝΘ§ΤδΆ―œθΖ¥”ΠΈΣΘΚ2NO2(g)+O3(g)![]() N2O5(g)+O2(g)ΓςH<0Θ§»τΖ¥”Π‘ΎΚψ»ίΟή±’»ίΤς÷–Ϋχ––Θ§»γ±μ”…ΗΟΖ¥”ΠœύΙΊΆΦœσΉς≥ωΒΡ≈–Εœ’ΐ»ΖΒΡ «Θ® Θ©
N2O5(g)+O2(g)ΓςH<0Θ§»τΖ¥”Π‘ΎΚψ»ίΟή±’»ίΤς÷–Ϋχ––Θ§»γ±μ”…ΗΟΖ¥”ΠœύΙΊΆΦœσΉς≥ωΒΡ≈–Εœ’ΐ»ΖΒΡ «Θ® Θ©
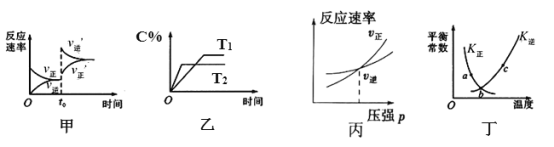
A.ΦΉΆΦ÷–ΗΡ±δΒΡΖ¥”ΠΧθΦΰΈΣ…ΐΈ¬
B.““ΆΦ÷–Έ¬Ε»T2>T1Θ§ΉίΉχ±ξΩ…¥ζ±μNO2ΒΡΑΌΖ÷Κ§ΝΩ
C.±ϊΆΦΈΣ≥δ»κœΓ”–ΤχΧε ±ΥΌ¬ ±δΜ·
D.ΕΓΆΦ÷–aΓΔbΓΔc»ΐΒψ÷Μ”–bΒψ“―Ψ≠¥οΒΫΤΫΚβΉ¥Χ§
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΜ‘Ά≠Ωσ «“Μ÷÷÷Ί“ΣΒΡΆ≠Ωσ ·Θ§÷ς“ΣΚ§”–ΝρΜ·―«Ά≠Θ®Cu2SΘ©Θ§ΜΙ”–Fe2O3ΓΔSiO2ΦΑ“Μ–©≤Μ»ή–‘‘”÷ ΓΘ“Μ÷÷“‘Μ‘Ά≠Ωσ ·ΈΣ‘≠Νœ÷Τ±ΗœθΥαΆ≠ΨßΧεΒΡΙΛ“’Νς≥Χ»γœ¬ΘΚ

“―÷ΣΘΚ≤ΩΖ÷Ϋπ τ―τάκΉ”…ζ≥…«β―θΜ·Έο≥ΝΒμΒΡpHΖΕΈß»γœ¬±μΥυ ΨΘ®ΩΣ Φ≥ΝΒμΒΡpHΑ¥Ϋπ τάκΉ”≈®Ε»ΈΣ1.0mol/LΦΤΥψΘ©
άκΉ” | ΩΣ Φ≥ΝΒμΒΡpH | Άξ»Ϊ≥ΝΒμΒΡpH |
Fe3+ | 1.1 | 3.2 |
Mn2+ | 8.3 | 9.8 |
Cu2+ | 4.4 | 6.4 |
ΜΊ¥πœ¬Ν–Έ Χβ
Θ®1Θ©Ϋΰ»ΓΚσΒΟΒΫΒΡΫΰ≥ω“Κ÷–Κ§”–CuSO4ΓΔMnSO4ΓΘ–¥≥ωΫΰ»Γ ±≤ζ…ζCuSO4ΓΔMnSO4Ζ¥”ΠΒΡΜ·―ßΖΫ≥Χ Ϋ__________ΓΘ
Θ®2Θ©ΒςΫΎpHΒΡΡΩΒΡ «___________Θ§pHΒΡΒςΫΎΖΕΈßΈΣ___________ΓΘ
Θ®3Θ©…ζ≥…MnCO3≥ΝΒμΒΡάκΉ”ΖΫ≥Χ ΫΈΣ___________ΓΘ
Θ®4Θ©≤ΌΉςAΈΣ___________ΓΘ
Θ®5Θ©”…Μ‘Ά≠Ωσ÷Τ»ΓΆ≠ΒΡΖ¥”ΠΙΐ≥ΧΩ…“‘±μ ΨΈΣΘΚ
2Cu2SΘ®sΘ©+3O2Θ®gΘ©®T 2Cu2OΘ®sΘ©+ 2SO2Θ®gΘ©ΓςH=©¹768.2kJ/mol
2Cu2OΘ®sΘ©+ Cu2SΘ®sΘ©®T 6CuΘ®sΘ©+ SO2Θ®gΘ©ΓςH=" +116.0" kJ/mol
‘ρ”…Cu2S”κO2Φ”»»Ζ¥”Π…ζ≥…CuΒΡ»»Μ·―ßΖΫ≥Χ ΫΈΣ___________ΓΘ
Θ®6Θ©»τ”ΟΚ§85% Cu2SΘ®Mr=160Θ©ΒΡΜ‘Ά≠Ωσά¥÷Τ±ΗΈόΥ°CuΘ®NO3Θ©2Θ§ΦΌ…ηΫΰ»Γ¬ ΈΣ95%Θ§ΒςΫΎpH ±ΥπCu 3%Θ§’τΑ±Ιΐ≥Χ÷–”–5%Έ¥ΉΣΜ·ΈΣCuOΘ§ΤδΥϋΙΐ≥Χ÷–ΈόΥπΚΡΘ§‘ρ1.6 kg’β―υΒΡΜ‘Ά≠ΩσΉνΕύΡή÷Τ±Η__________molΈόΥ°CuΘ®NO3Θ©2ΓΘ(ΦΤΥψΫαΙϊΨΪ»ΖΒΫ–Γ ΐΒψΚσ1ΈΜ)
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΦΉ»©(HCHO)Θ§Έό…ΪΤχΧεΘ§“Ή»ή”ΎΥ°Θ§”–ΧΊ βΒΡ¥ΧΈΔΤχΈΕΘ§Ε‘»Υ―έΓΔ±«Β»”–¥ΧΦΛΉς”ΟΓΘ40%ΦΉ»©»ή“ΚΖ–ΒψΈΣ96ΓφΘ§“ΉΜ”ΖΔΓΘΦΉ»©‘ΎΦν–‘»ή“Κ÷–ΨΏ”–ΦΪ«ΩΒΡΜΙ‘≠–‘ΓΘΈΣΧΫΨΩΙΐΝΩΦΉ»©ΚΆ–¬÷ΤCu(OH)2Ζ¥”ΠΒΡ≤ζΈο≥…Ζ÷Θ§Ϋχ––»γœ¬―–ΨΩΘΚ
Θ®1Θ©‘Ύœ¬ΆΦΉΑ÷Ο÷–Ϋχ–– Β―ιΘ§œρa÷–Φ”»κ0.5molΓΛL-1CuSO4»ή“Κ50mLΚΆ5 molΓΛL-1 NaOH»ή“Κ100mLΘ§’ώΒ¥Θ§‘ΌΦ”»κ40%ΒΡΦΉ»©»ή“Κ40mLΘ§ΜΚ¬ΐΦ”»»aΘ§‘Ύ65Γφ ±ΜΊΝς20Ζ÷÷”Κσά以÷Ν “Έ¬ΓΘΖ¥”ΠΙΐ≥Χ÷–Ιέ≤λΒΫ”–ΉΊ…ΪΙΧΧε…ζ≥…Θ§ΉνΚσ±δ≥…Κλ…ΪΘ§≤Δ”–ΤχΧε≤ζ…ζΓΘ

ΔΌ“«ΤςbΒΡΟϊ≥Τ «____________ΓΘ
ΔΎ“«ΤςcΒΡΉς”ΟΈΣ____________ΓΘ
ΔέΡήΥΒΟςΦΉ»©ΨΏ”–ΜΙ‘≠–‘ΒΡ Β―ιœ÷œσ «____________ΓΘ
Θ®2Θ©≤ι‘ΡΉ ΝœΖΔœ÷ΤχΧε≤ζΈο «Η±Ζ¥”Π≤ζ…ζΒΡΓΘΈΣ»Ζ»œΤχΧε≤ζΈο÷–Κ§H2≤ΜΚ§COΘ§ΫΪΉΑ÷ΟAΚΆ»γœ¬ΆΦΥυ ΨΒΡΉΑ÷ΟΝ§Ϋ”ΚσΫχ–– Β―ιΓΘ

ΔΌ“ά¥ΈΝ§Ϋ”ΒΡΚœάμΥ≥–ρΈΣΘΚAΓζBΓζ_____Γζ_____Γζ_____Γζ_____ΓζGΘ§________
ΔΎΉΑ÷ΟBΒΡΉς”Ο «_______________ΓΘ
Δέ»Ζ»œΤχΧε≤ζΈο÷–Κ§H2Εχ≤ΜΚ§COΒΡœ÷œσ «_________________________ΓΘ
Θ®3Θ©“―÷ΣΘΚ![]() ΓΘ÷ΛΟςa÷–ΦΉ»©ΒΡΧΦ‘ΣΥΊΈ¥±Μ―θΜ·≥…+4ΦέΒΡ Β―ιΖΫΑΗΈΣΘΚ»Γ…ΌΝΩa÷–Ζ¥”ΠΚσΒΡ«ε“ΚΘ§____________________Θ§‘ρΥΒΟςΦΉ»©ΒΡΧΦ‘ΣΥΊΈ¥±Μ―θΜ·≥…+4ΦέΓΘ
ΓΘ÷ΛΟςa÷–ΦΉ»©ΒΡΧΦ‘ΣΥΊΈ¥±Μ―θΜ·≥…+4ΦέΒΡ Β―ιΖΫΑΗΈΣΘΚ»Γ…ΌΝΩa÷–Ζ¥”ΠΚσΒΡ«ε“ΚΘ§____________________Θ§‘ρΥΒΟςΦΉ»©ΒΡΧΦ‘ΣΥΊΈ¥±Μ―θΜ·≥…+4ΦέΓΘ
Θ®4Θ©ΈΣ―–ΨΩΚλ…ΪΙΧΧε≤ζΈοΒΡΉι≥…Θ§Ϋχ––»γœ¬ Β―ι(“‘œ¬ΟΩ≤ΫΨυ≥δΖ÷Ζ¥”Π)ΘΜ

“―÷ΣΘΚΔΓ.Cu2O ![]() [Cu(NH3)4]+(Έό…Ϊ)
[Cu(NH3)4]+(Έό…Ϊ) ![]() [Cu(NH3)4]2+(άΕ…Ϊ)
[Cu(NH3)4]2+(άΕ…Ϊ)
ΔΔ.2Cu+8NH3ΓΛH2O+O2=2[Cu(NH3)4]2++4OH-+6H2O
Ά®Ιΐ…œ ω Β―ιΘ§Ω…“‘ΒΟ≥ωΚλ…ΪΙΧΧε≤ζΈο÷ς“Σ «_______________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ≥ΘΈ¬œ¬Θ§œ¬Ν–ΗςΉιάκΉ”‘Ύ÷ΗΕ®»ή“Κ÷–“ΜΕ®Ρή¥σΝΩΙ≤¥φΒΡ «( )
A.”…Υ°Βγάκ≥ωΒΡH+≈®Ε»ΈΣ1ΓΝ10-9 mol/LΒΡ»ή“Κ÷–ΘΚAl3+ΓΔ![]() ΓΔNa+ΓΔCl-
ΓΔNa+ΓΔCl-
B.”ωΖ”ΧΣ±δΚλΒΡ»ή“Κ÷–ΘΚ![]() ΓΔNa+ΓΔ
ΓΔNa+ΓΔ![]() ΓΔK+
ΓΔK+
C.c(![]() )=1mol/LΒΡ»ή“Κ÷–ΘΚH+ΓΔFe2+ΓΔCl-ΓΔ
)=1mol/LΒΡ»ή“Κ÷–ΘΚH+ΓΔFe2+ΓΔCl-ΓΔ![]()
D.pH=1ΒΡ»ή“Κ÷–ΘΚ![]() ΓΔ
ΓΔ![]() ΓΔK+ΓΔCl-
ΓΔK+ΓΔCl-
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com