
【题目】以苯和乙炔为原料合成化工原料E的路线如下:

回答下列问题:
(1)以下有关苯和乙炔的认识正确的是 ______
![]() 苯和乙炔都能使溴水褪色,前者为化学变化,后者为物理变化
苯和乙炔都能使溴水褪色,前者为化学变化,后者为物理变化
![]() 苯和乙炔在空气中燃烧都有浓烟产生
苯和乙炔在空气中燃烧都有浓烟产生
![]() 苯与浓硝酸混合,水浴加热55~60℃,生成硝基苯
苯与浓硝酸混合,水浴加热55~60℃,生成硝基苯
![]() 聚乙炔是一种有导电特性的高分子化合物
聚乙炔是一种有导电特性的高分子化合物
(2)A的名称 ______。
(3)生成B的化学方程式为 ______,反应类型是 ______。
(4)C的结构简式为 ______ ,C的分子中一定共面的碳原子最多有 ______ 个。
(5)与D同类别且有二个六元环结构(环与环之间用单键连接)的同分异构体有______种,请任写两种同分异构体的结构简式:______。
(6)参照上述合成路线,设计一条以乙炔和必要试剂合成环丙烷的路线: ______。
【答案】bd 苯甲醇 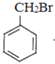 +HC≡CNa→
+HC≡CNa→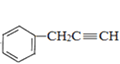 +NaBr 取代反应
+NaBr 取代反应 ![]() 7 4
7 4 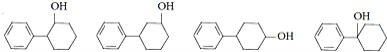
![]()
【解析】
苯与甲醛发生加成反应生成A为![]() ,A与HBr发生取代反应生成
,A与HBr发生取代反应生成![]() ,再与HC≡CNa发生取代反应生成B为
,再与HC≡CNa发生取代反应生成B为![]() ,
,![]() 与H2发生加成反应生成C,结合C的分子式可知C为
与H2发生加成反应生成C,结合C的分子式可知C为![]() ,结合E的结构可知C与CH2I2反应生成D为
,结合E的结构可知C与CH2I2反应生成D为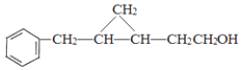 ,D发生氧化反应生成E
,D发生氧化反应生成E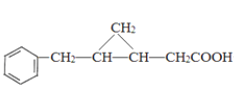 。据此解答。
。据此解答。
(1)a.苯和乙炔都能使溴水褪色,前者为萃取作用,发生的是物理变化,后者发生加成反应,属于化学变化,a错误;
![]() 苯和乙炔的最简式相同都是CH,二者含碳量高,在空气中燃烧都有浓烟产生,b正确;
苯和乙炔的最简式相同都是CH,二者含碳量高,在空气中燃烧都有浓烟产生,b正确;
![]() 苯与浓硝酸混合,水浴加热55~60℃,生成硝基苯和H2O,需要浓硫酸作催化剂,c错误;
苯与浓硝酸混合,水浴加热55~60℃,生成硝基苯和H2O,需要浓硫酸作催化剂,c错误;
![]() 聚乙炔是一种有导电特性的高分子化合物,d正确;
聚乙炔是一种有导电特性的高分子化合物,d正确;
故合理选项是bd;
(2)A结构简式为![]() ,名称为苯甲醇;
,名称为苯甲醇;
(3)生成B的化学方程式为: +HC≡CNa→
+HC≡CNa→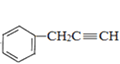 +NaBr,反应类型为取代反应;
+NaBr,反应类型为取代反应;
(4)C的结构简式为![]() ,与苯环连接的C原子处于苯环的平面上,碳碳双键连接的原子处于同一平面,由于碳碳单键可以旋转,所以乙烯平面与苯环平面可能不在同一平面上,与-OH连接的C原子是正四面体结构,可能不在乙烯的平面上,所以最多有7个碳原子可以共平面;
,与苯环连接的C原子处于苯环的平面上,碳碳双键连接的原子处于同一平面,由于碳碳单键可以旋转,所以乙烯平面与苯环平面可能不在同一平面上,与-OH连接的C原子是正四面体结构,可能不在乙烯的平面上,所以最多有7个碳原子可以共平面;
(5)与![]()
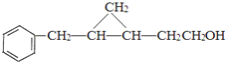
![]() 同类别且有二个六元环结构
同类别且有二个六元环结构![]() 环与环之间用单键连接
环与环之间用单键连接![]() 的同分异构体有:
的同分异构体有: ,共有四种;
,共有四种;
(6)CH≡CH与H2发生加成反应产生CH2=CH2,CH2=CH2与CH2I2发生反应产生环丙烷,所以以乙炔和必要试剂合成环丙烷的路线:![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
已知:C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
H2(g)+![]() O2(g)===H2O(g) ΔH2=-241.8 kJ·mol-1
O2(g)===H2O(g) ΔH2=-241.8 kJ·mol-1
CO(g)+![]() O2(g)===CO2(g) ΔH3=-283.0 kJ·mol-1
O2(g)===CO2(g) ΔH3=-283.0 kJ·mol-1
则煤气化主要反应C(s)+H2O(g)=CO(g)+H2(g)的ΔH=____________________。
Ⅱ.为了减少CO的排放,某环境研究小组以CO和H2为原料合成清洁能源二甲醚(DME),反应如下:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g) ΔH=-198 kJ·mol-1。
CH3OCH3(g)+H2O(g) ΔH=-198 kJ·mol-1。
(1)如图所示能正确反映平衡常数K随温度变化关系的曲线为________(填曲线标记字母),其判断理由是____________。

(2)在一定温度下,向2.0 L固定容积的密闭容器中充入2 mol H2和1 mol CO,经过一段时间后,反应4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g)达到平衡。反应过程中测得的部分数据见下表:
CH3OCH3(g)+H2O(g)达到平衡。反应过程中测得的部分数据见下表:
时间/min | 0 | 20 | 40 | 80 | 100 |
n(H2)/mol | 2.0 | 1.4 | 0.85 | 0.4 | — |
n(CO)/mol | 1.0 | — | 0.425 | 0.2 | 0.2 |
n(CH3OCH3)/mol | 0 | 0.15 | — | — | 0.4 |
n(H2O)/mol | 0 | 0.15 | 0.2875 | 0.4 | 0.4 |
①0~20 min的平均反应速率v(CO)=__________________mol·L-1·min-1;
②达到平衡时,H2的转化率为__________________;
③在上述温度下,该反应的平衡常数K=______________________;
④能表明该反应达到平衡状态的是________(填序号);
A CO的转化率等于H2O的产率 B 混合气体的平均相对分子质量不变
C v(CO)与v(H2)的比值不变 D 混合气体的密度不变
⑤在上述温度下,向平衡后的2 L容器中再充入0.4 mol H2和0.4 mol CH3OCH3(g),则化学平衡________移动(填“向左”“向右”或“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化钪![]() 广泛应用在合金电光源,催化剂,激活剂等领域,下列流程图是用钪精矿生产氧化钪的方法之一:
广泛应用在合金电光源,催化剂,激活剂等领域,下列流程图是用钪精矿生产氧化钪的方法之一:![]() 钪精矿主要成分是钪的氧化物,硅铁等氧化物
钪精矿主要成分是钪的氧化物,硅铁等氧化物![]()
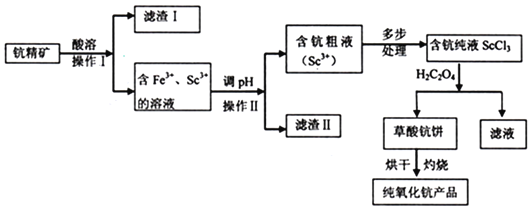
回答下列问题:
![]() 滤渣I是______
滤渣I是______![]() 填化学式
填化学式![]() 。在实验室里,操作Ⅰ必要的玻璃仪器有烧杯、______。
。在实验室里,操作Ⅰ必要的玻璃仪器有烧杯、______。
![]() 调pH的目的是______,如何检验含钪粗液中不含
调pH的目的是______,如何检验含钪粗液中不含![]() 离子______。
离子______。
![]() 写出制取草酸钪饼的化学方程式______。
写出制取草酸钪饼的化学方程式______。
![]() 写出草酸钪饼在空气中灼烧的化学方程式______,每生成
写出草酸钪饼在空气中灼烧的化学方程式______,每生成![]() ,转移的电子数为______。
,转移的电子数为______。
![]() 某工厂用
某工厂用![]() 的钪精矿制备纯氧化钪,得到纯产品
的钪精矿制备纯氧化钪,得到纯产品![]() ,则钪精矿中钪的质量分数是______
,则钪精矿中钪的质量分数是______![]() 假设Sc的利用率为
假设Sc的利用率为![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取乙酸乙酯的实验装置如图所示,下列说法正确的是( )

A.试管A中,依次加入的是浓硫酸、乙醇、乙酸
B.B中加入的是饱和Na2CO3溶液
C.B中的导管也可以伸入到液面以下
D.实验结束,B的下层出现少量油层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下:

(1)焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S![]() 2Al2O3+9SO2,该反应的氧化剂是_______。若生成l molAl2O3,则转移的电子数为__________________。
2Al2O3+9SO2,该反应的氧化剂是_______。若生成l molAl2O3,则转移的电子数为__________________。
(2)熟料溶解时,反应的离子方程式为___________________________________________。
(3)母液中溶质主要成分的化学式为_____________________________________________。
(4)将标准状况下1.12L炉气通入100mL 0.5mol·L-1NaOH溶液中,得到一种酸性溶液,则该溶液中各种离子浓度由大到小的排列顺序为____________________________。
(5)检验废渣中主要成分的方法是_____________________________________________________(写出操作步骤、现象及结论)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醛在一定条件下可以两分子加成:RCH2CHO+RCH2CHO![]()
![]() ,加成产物不稳定,受热即脱水而生成不饱和醛:
,加成产物不稳定,受热即脱水而生成不饱和醛:![]()
![]()
![]() +H2O。已知物质B是一种可作为药物的芳香族化合物,请根据如图(所有无机产物已略去)中各有机物的转化关系回答问题:
+H2O。已知物质B是一种可作为药物的芳香族化合物,请根据如图(所有无机产物已略去)中各有机物的转化关系回答问题:

(1)物质B所含官能团的名称 ______,B结构简式为 ______;
(2)物质A的核磁共振氢谱有 ______个峰。
(3)写出E→F的化学方程式 ______。
(4)写出G与D反应生成H的化学方程式 ______。
(5)F若与H2发生加反应,1molF最多消耗的H2的物质的量为______mol。
(6)芳香族化合物M与B互为同分异构体,且含有相同的官能团,试写出所有M结构简式 ____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钠俗称红矾钠![]() ,是重要的化工产品和强氧化剂.工业制备红矾钠的流程如下:
,是重要的化工产品和强氧化剂.工业制备红矾钠的流程如下:
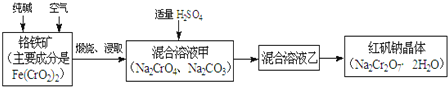
(1)化学上可将某些盐写成氧化物的形式,如![]() 可写成
可写成![]() ,则
,则![]() 可写成______.
可写成______.
(2)煅烧铬铁矿时,矿石中难溶的![]() 生成可溶于水的
生成可溶于水的![]() ,反应化学方程式如下:
,反应化学方程式如下:![]() 为了加快该反应的反应速率,可采取的措施是______
为了加快该反应的反应速率,可采取的措施是______![]() 写一种即可
写一种即可![]()
(3)已知![]() 在不同的酸性溶液中有不同的反应,如:
在不同的酸性溶液中有不同的反应,如:
![]() ;
;![]()
①往混合溶液甲中加入硫酸必须适量的原因是______.
②混合溶液乙中溶质的化学式是______.
(4)在含![]() 废水中存在着平衡:
废水中存在着平衡:![]() ,请写出该平衡的平衡常数表达式
,请写出该平衡的平衡常数表达式![]() ______,若继续加水稀释,平衡将______移动
______,若继续加水稀释,平衡将______移动![]() 填“正向”、“逆向”“不”
填“正向”、“逆向”“不”![]() .
.
(5)请配平碱性溶液还原法中发生的离子反应:
______![]() ___
___![]() ______
______![]() --______
--______![]() ______
______![]() ______
______![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖酸亚铁[(C6H11O7)2Fe]是医疗上常用的补铁剂,易溶于水,几乎不溶于乙醇。某实验小组同学拟用下图装置先制备FeCO3,再用FeCO3与葡萄糖酸反应进一步制得葡萄糖酸亚铁。
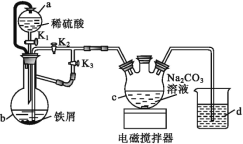
请回答下列问题:
(1)与普通漏斗比较,a漏斗的优点是___。
(2)按如图连接好装置,检査气密性后加入药品,打开K1和K3,关闭K2。
①b中的实验现象___。
②一段时间后,关闭___,打开___(选填“K1”“K2”或“K3”),观察到b中的溶液会流入c中,同时c中析出FeCO3沉淀。
③b中产生的气体的作用是___。
(3)将c中制得的碳酸亚铁在空气中过滤时间较长时,表面会变为红褐色,用化学方程式说明其原因:___。
(4)将葡萄糖酸与碳酸亚铁混合,须将溶液的pH调节至5.8,其原因是___。向上述溶液中加入乙醇即可析出产品,加入乙醇的目的是___。
(5)有同学提出用NaHCO3溶液代替Na2CO3溶液制得的碳酸亚铁纯度更高,其可能的原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源等(如图所示),
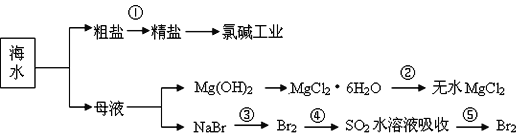
下列有关说法正确的是
A.第①步中除去粗盐中的![]() 、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为: Na2CO3溶液→BaCl2溶液→NaOH溶液→过滤→适量盐酸调pH
、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为: Na2CO3溶液→BaCl2溶液→NaOH溶液→过滤→适量盐酸调pH
B.MgSO4·7H2O在空气中加热可制得无水MgSO4的方法与第②步相似。
C.从第③步到第⑤步的目的是为了浓缩富集Br2
D.在第③④⑤步中溴元素均被氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com