
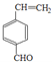
【题目】醛在一定条件下可以两分子加成:RCH2CHO+RCH2CHO![]()
![]() ,加成产物不稳定,受热即脱水而生成不饱和醛:
,加成产物不稳定,受热即脱水而生成不饱和醛:![]()
![]()
![]() +H2O。已知物质B是一种可作为药物的芳香族化合物,请根据如图(所有无机产物已略去)中各有机物的转化关系回答问题:
+H2O。已知物质B是一种可作为药物的芳香族化合物,请根据如图(所有无机产物已略去)中各有机物的转化关系回答问题:

(1)物质B所含官能团的名称 ______,B结构简式为 ______;
(2)物质A的核磁共振氢谱有 ______个峰。
(3)写出E→F的化学方程式 ______。
(4)写出G与D反应生成H的化学方程式 ______。
(5)F若与H2发生加反应,1molF最多消耗的H2的物质的量为______mol。
(6)芳香族化合物M与B互为同分异构体,且含有相同的官能团,试写出所有M结构简式 ____________。
【答案】碳碳双键和醛基 ![]() 4
4 ![]() +2NaOH
+2NaOH![]()
![]() +2NaBr+2H2O
+2NaBr+2H2O ![]()
![]()
![]()
![]()
![]() +H2O 5
+H2O 5 ![]() 、
、![]() 、
、![]() ;
;
【解析】
C分子式为C9H8O2,B发生银镜反应生成C,则B中含有醛基,C中含有-COOH,B的分子式为C9H8O,B的不饱和度为![]() =6,B属于芳香族化合物,苯环不饱和度为4,-CHO不饱和度为1,因此B分子中还含有1个C=C双键,A与乙醛加成生成B,由醛加成反应的信息可知,A为
=6,B属于芳香族化合物,苯环不饱和度为4,-CHO不饱和度为1,因此B分子中还含有1个C=C双键,A与乙醛加成生成B,由醛加成反应的信息可知,A为![]() ,则B为
,则B为![]() ,C为
,C为![]() ,C与Br2发生加成反应生成E,E为
,C与Br2发生加成反应生成E,E为![]() ,E在氢氧化钠的乙醇溶液、加热条件下发生消去反应生成F,则F为
,E在氢氧化钠的乙醇溶液、加热条件下发生消去反应生成F,则F为![]() ,C与H2加成生成D,D中含有-COOH,D与G反应生成H,H为酯,G含有-OH,H分子式为C18H20O2,不饱和度为
,C与H2加成生成D,D中含有-COOH,D与G反应生成H,H为酯,G含有-OH,H分子式为C18H20O2,不饱和度为![]() =9,故H分子含有2个苯环,则D为
=9,故H分子含有2个苯环,则D为![]() ,G为
,G为![]() ,H为
,H为![]() ,据此解答。
,据此解答。
(1)根据上面的分析可知物质B的结构简式为![]() ,B分子中所含官能团的名称为碳碳双键和醛基;
,B分子中所含官能团的名称为碳碳双键和醛基;
(2)A的结构为![]() ,根据物质分子结构的对称性,可知A的核磁共振氢谱有4个峰;
,根据物质分子结构的对称性,可知A的核磁共振氢谱有4个峰;
(3)物质E的结构简式为![]() ,E与NaOH的乙醇溶液共热,发生消去反应产生F,则E→F的化学方程式为:
,E与NaOH的乙醇溶液共热,发生消去反应产生F,则E→F的化学方程式为:![]() +2NaOH
+2NaOH![]()
![]() +2NaBr+2H2O;
+2NaBr+2H2O;
(4)G是![]() ,D是
,D是![]() ,二者发生酯化反应生成酯H,该反应的化学方程式为:
,二者发生酯化反应生成酯H,该反应的化学方程式为:![]()
![]()
![]()
![]()
![]() +H2O;
+H2O;
(5)F为![]() ,F若与H2发生加反应,苯环和碳碳叁键都能与H2加成,而-COOH不能发生加成反应,所以1molF最多消耗的氢气的物质的量为 5mol;
,F若与H2发生加反应,苯环和碳碳叁键都能与H2加成,而-COOH不能发生加成反应,所以1molF最多消耗的氢气的物质的量为 5mol;
(6)B为![]() ,芳香族化合物M与B互为同分异构体,且含有相同的官能团,则M可能的结构简式为
,芳香族化合物M与B互为同分异构体,且含有相同的官能团,则M可能的结构简式为![]() 、
、![]() 、
、 、
、![]() 。
。


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
【题目】2019年12月以来,我国武汉等地相继暴发了新冠肺炎,为此我国政府和相关部门采取了多项措施控制疫情。75%乙醇和84消毒液等均能有效灭活新冠病毒。84消毒液的主要成分是次氯酸钠。设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.74.5g次氯酸钠中含有的离子数目为2NA
B.1mol次氯酸钠与足量盐酸反应转移的电子数为2NA
C.46g75%乙醇中含有的氧原子数大于6NA
D.利用氯气和氢氧化钠溶液反应制取0.1mol次氯酸钠需要消耗2.24L氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能源是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙。将6.00g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72LH2(已折算成标准状况),甲与水反应也能产生H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状态下的密度为1.25g/L。请回答下列问题:
(1)甲的化学式是__________;乙的电子式是__________。
(2)甲与水反应的化学方程式是__________。
(3)气体丙与金属镁反应的产物是__________(用化学式表示)。
(4)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式__________。有人提出产物Cu中可能还含有Cu2O,请设计实验方案验证之__________(已知Cu2O+2H+=Cu+Cu2++H2O)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尿素[CO(NH2)2]是首个由无机物人工合成的有机物。工业上合成尿素的反应如下:2NH3(g)+CO2(g) ![]() CO(NH2)2(l)+H2O(l) △H<0。回答下列问题:
CO(NH2)2(l)+H2O(l) △H<0。回答下列问题:
(1)已知工业上合成尿素分两步进行,相关反应如下:
反应Ⅰ:2NH3(g)+CO2(g) ![]() NH2COONH4(s) △H1<0
NH2COONH4(s) △H1<0
反应Ⅱ:NH2COONH4(s) ![]() CO(NH2)2(l)+H2O(l) △H2>0
CO(NH2)2(l)+H2O(l) △H2>0
①△H=________________(用△H1、△H2表示)
②下列示意图中[a表示2NH3(g)+CO2(g),b表示NH2COONH4(s),c表示CO(NH2)2(l)+H2O(l)],能正确表示尿素合成过程中能量变化曲线是(填编号)______。
(2)某实验小组模拟工业上合成尿素的条件,在恒定温度下,将氨气和二氧化碳按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质浓度的变化曲线如下图所示。

①可以判断该化合反应已经达到化学平衡的是_________。(填编号)
A.![]() B.密闭容器中总压强不变
B.密闭容器中总压强不变
C.密闭容器中氨气的体积分数不变 D.密闭容器中混合气体的密度不变
②在上述条件下,从反应开始至20min时,二氧化碳的平均反应速率为____________。
③该反应的平衡常数表达式K=____________。
(3)人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如下图所示。

阳极室中发生的反应依次为_____________________、____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以苯和乙炔为原料合成化工原料E的路线如下:

回答下列问题:
(1)以下有关苯和乙炔的认识正确的是 ______
![]() 苯和乙炔都能使溴水褪色,前者为化学变化,后者为物理变化
苯和乙炔都能使溴水褪色,前者为化学变化,后者为物理变化
![]() 苯和乙炔在空气中燃烧都有浓烟产生
苯和乙炔在空气中燃烧都有浓烟产生
![]() 苯与浓硝酸混合,水浴加热55~60℃,生成硝基苯
苯与浓硝酸混合,水浴加热55~60℃,生成硝基苯
![]() 聚乙炔是一种有导电特性的高分子化合物
聚乙炔是一种有导电特性的高分子化合物
(2)A的名称 ______。
(3)生成B的化学方程式为 ______,反应类型是 ______。
(4)C的结构简式为 ______ ,C的分子中一定共面的碳原子最多有 ______ 个。
(5)与D同类别且有二个六元环结构(环与环之间用单键连接)的同分异构体有______种,请任写两种同分异构体的结构简式:______。
(6)参照上述合成路线,设计一条以乙炔和必要试剂合成环丙烷的路线: ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚苯乙烯(PS)和聚对苯二甲酸乙二醇酯(PET)材料具有高韧性、质轻、耐酸碱等性能,在生产生活中应用广泛。这两种聚合物可按下图路线合成,请回答下列问题:

(1)A的分子式为______,其核磁共振氢谱有______组(个)吸收峰。
(2)含有苯环的B的同分异构体有______种。
(3)D为苯乙烯,其结构简式为______,官能团为______。
(4)F的名称为______,由E→G的反应类型是______(填“缩聚”或“加聚”)反应。
(5)已知:
![]()
![]()
![]()
![]()
![]()
写出由BrCH2CH2Br制备HOOC-CH2CH2-COOH的合成路线:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝试剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g)△H<0,若反应在恒容密闭容器中进行,如表由该反应相关图象作出的判断正确的是( )
N2O5(g)+O2(g)△H<0,若反应在恒容密闭容器中进行,如表由该反应相关图象作出的判断正确的是( )
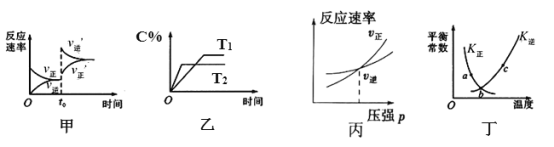
A.甲图中改变的反应条件为升温
B.乙图中温度T2>T1,纵坐标可代表NO2的百分含量
C.丙图为充入稀有气体时速率变化
D.丁图中a、b、c三点只有b点已经达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫是一种自然界分布较广的元素,在很多化合物中都含有该元素,回答下列问题:

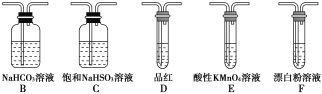
(1)装置A中反应的化学方程式为______________________________________。
(2)使分液漏斗中液体顺利流下的操作是_________________________。
(3)选用上面的装置和药品探究亚硫酸与次氯酸的酸性强弱:
①甲同学认为按照A→C→F的顺序连接装置即可证明,乙同学认为该方案不合理,其理由是_________
②丙同学设计的合理实验方案为A→C→________→________→D→F,其中装置C的作用是______,证明亚硫酸的酸性强于次氯酸的实验现象是____________
(4)K2S2O8具有强氧化性,可通过电解H2SO4和K2SO4的混合溶液制得,其阳极反应式为_________,称取0.250 0 g 产品于碘量瓶中,加100 mL水溶解,再加入8.000 g KI固体(稍过量),振荡使其充分反应;加入适量醋酸溶液酸化,以淀粉为指示剂,用 c mol/L的Na2S2O3标准液滴定至终点,消耗Na2S2O3标准液V mL,则样品中K2S2O8的纯度为________%(用含c、V的代数式表示,已知:S2O82-+2I-===2SO42-+I2 ;2S2O32-+I2===2S4O82-+2I- )。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列说法正确的是( )

A.c点对应的溶液pH=6,显酸性B.T℃ 下,水的离子积常数为1×10-12
C.T<25℃D.纯水仅升高温度,可以从a点变到d
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com