
【题目】臭氧是理想的烟气脱硝试剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g)△H<0,若反应在恒容密闭容器中进行,如表由该反应相关图象作出的判断正确的是( )
N2O5(g)+O2(g)△H<0,若反应在恒容密闭容器中进行,如表由该反应相关图象作出的判断正确的是( )
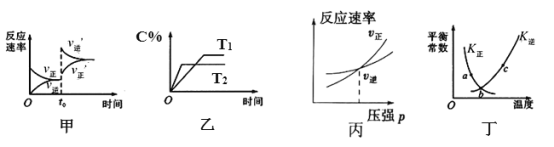
A.甲图中改变的反应条件为升温
B.乙图中温度T2>T1,纵坐标可代表NO2的百分含量
C.丙图为充入稀有气体时速率变化
D.丁图中a、b、c三点只有b点已经达到平衡状态
 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
【题目】下列图象正确的是( )
A. 向 Ca(OH)2和 NaOH的混合溶液中通 入CO2
B. 向 FeCl3 溶液中加入锌粉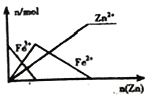
C. 向 NaOH 溶液中通入CO2
D. HCl与Cl2的混合气体通入NaOH溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取乙酸乙酯的实验装置如图所示,下列说法正确的是( )

A.试管A中,依次加入的是浓硫酸、乙醇、乙酸
B.B中加入的是饱和Na2CO3溶液
C.B中的导管也可以伸入到液面以下
D.实验结束,B的下层出现少量油层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醛在一定条件下可以两分子加成:RCH2CHO+RCH2CHO![]()
![]() ,加成产物不稳定,受热即脱水而生成不饱和醛:
,加成产物不稳定,受热即脱水而生成不饱和醛:![]()
![]()
![]() +H2O。已知物质B是一种可作为药物的芳香族化合物,请根据如图(所有无机产物已略去)中各有机物的转化关系回答问题:
+H2O。已知物质B是一种可作为药物的芳香族化合物,请根据如图(所有无机产物已略去)中各有机物的转化关系回答问题:

(1)物质B所含官能团的名称 ______,B结构简式为 ______;
(2)物质A的核磁共振氢谱有 ______个峰。
(3)写出E→F的化学方程式 ______。
(4)写出G与D反应生成H的化学方程式 ______。
(5)F若与H2发生加反应,1molF最多消耗的H2的物质的量为______mol。
(6)芳香族化合物M与B互为同分异构体,且含有相同的官能团,试写出所有M结构简式 ____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钠俗称红矾钠![]() ,是重要的化工产品和强氧化剂.工业制备红矾钠的流程如下:
,是重要的化工产品和强氧化剂.工业制备红矾钠的流程如下:
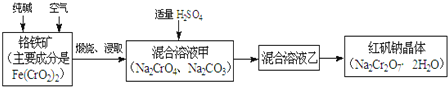
(1)化学上可将某些盐写成氧化物的形式,如![]() 可写成
可写成![]() ,则
,则![]() 可写成______.
可写成______.
(2)煅烧铬铁矿时,矿石中难溶的![]() 生成可溶于水的
生成可溶于水的![]() ,反应化学方程式如下:
,反应化学方程式如下:![]() 为了加快该反应的反应速率,可采取的措施是______
为了加快该反应的反应速率,可采取的措施是______![]() 写一种即可
写一种即可![]()
(3)已知![]() 在不同的酸性溶液中有不同的反应,如:
在不同的酸性溶液中有不同的反应,如:
![]() ;
;![]()
①往混合溶液甲中加入硫酸必须适量的原因是______.
②混合溶液乙中溶质的化学式是______.
(4)在含![]() 废水中存在着平衡:
废水中存在着平衡:![]() ,请写出该平衡的平衡常数表达式
,请写出该平衡的平衡常数表达式![]() ______,若继续加水稀释,平衡将______移动
______,若继续加水稀释,平衡将______移动![]() 填“正向”、“逆向”“不”
填“正向”、“逆向”“不”![]() .
.
(5)请配平碱性溶液还原法中发生的离子反应:
______![]() ___
___![]() ______
______![]() --______
--______![]() ______
______![]() ______
______![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年2月16日李克强总理到东北调研经济情况,重点走访了钢铁厂,鼓励钢铁厂提高钢铁质量和产量,铁及其化合物在日常生活中应用广泛。
(1)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理。已知含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4 H+=4Fe3++2H2O,则另一反应的离子方程式为__________;
(2)氧化铁是重要工业颜料,下面是制备氧化铁的一种方法,其流程如下:

①操作Ⅰ的名称是__________;操作Ⅱ为洗涤,洗涤操作的具体方法为__________;
②滤液A中加入稍过量的NH4HCO3溶液生成沉淀同时有一种气体产生,写出其化学方程式: __________;
(3)如果煅烧不充分,产品中将有FeO存在,称取3.0 g氧化铁产品,溶解,在250 mL容量瓶中定容;量取25.00 mL待测溶液于锥形瓶中,用酸化的0.01000 mol/L KMnO4溶液滴定至终点,重复滴定2-3次,消耗KMnO4溶液体积的平均值为20.00 mL,
①该实验中的KMnO4溶液需要酸化,用于酸化的酸是__________(填字母序号)。
a.稀硝酸 b.稀盐酸 c.稀硫酸 d.浓硝酸
②计算上述产品中Fe2O3的质量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖酸亚铁[(C6H11O7)2Fe]是医疗上常用的补铁剂,易溶于水,几乎不溶于乙醇。某实验小组同学拟用下图装置先制备FeCO3,再用FeCO3与葡萄糖酸反应进一步制得葡萄糖酸亚铁。
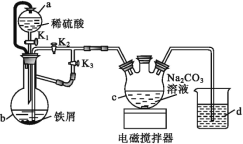
请回答下列问题:
(1)与普通漏斗比较,a漏斗的优点是___。
(2)按如图连接好装置,检査气密性后加入药品,打开K1和K3,关闭K2。
①b中的实验现象___。
②一段时间后,关闭___,打开___(选填“K1”“K2”或“K3”),观察到b中的溶液会流入c中,同时c中析出FeCO3沉淀。
③b中产生的气体的作用是___。
(3)将c中制得的碳酸亚铁在空气中过滤时间较长时,表面会变为红褐色,用化学方程式说明其原因:___。
(4)将葡萄糖酸与碳酸亚铁混合,须将溶液的pH调节至5.8,其原因是___。向上述溶液中加入乙醇即可析出产品,加入乙醇的目的是___。
(5)有同学提出用NaHCO3溶液代替Na2CO3溶液制得的碳酸亚铁纯度更高,其可能的原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O ![]() Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是( )
Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是( )
A.放电时负极得电子,质量减轻
B.放电时负极附近的pH增大
C.充电时该电池的正极与外加电源的负极相连
D.充电时阳极反应:Ni(OH)2-e-+OH-=NiOOH+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝氢化钠(NaAlH4)是有机合成的一种重要还原剂。一般的制备方法是将AlC13溶于有机溶剂,再把所得溶液滴加到NaH粉末上,可制得铝氢化钠。实验要求和装置如下,回答下列问题:
(1)制取铝氢化钠要在非水溶液中进行,主要原因是_______(用化学方程式表示)。用下列装置制取少量铝氢化钠(含副产物处理)较为合理的是__________。

(2)对于原料A1C13的制取,某兴趣小组设计了如下装置:

①连接好装置后,应进行的第一步操作是_________;为保证产物的纯净,应待D中__________(填现象)再加热酒精灯。
②B装置中盛装饱和NaCl溶液,实验开始后B中产生的现象是_________,选择饱和NaCl溶液的理由是_____。
③C装置的作用是_________;若无C装置,试预测实验后D中生成物除A1C13外可能还含有_________。(填化学式)
④上述装置存在的明显缺陷是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com