
【题目】硫是一种自然界分布较广的元素,在很多化合物中都含有该元素,回答下列问题:

(1)装置A中反应的化学方程式为______________________________________。
(2)使分液漏斗中液体顺利流下的操作是_________________________。
(3)选用上面的装置和药品探究亚硫酸与次氯酸的酸性强弱:
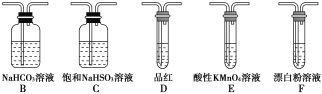
①甲同学认为按照A→C→F的顺序连接装置即可证明,乙同学认为该方案不合理,其理由是_________
②丙同学设计的合理实验方案为A→C→________→________→D→F,其中装置C的作用是______,证明亚硫酸的酸性强于次氯酸的实验现象是____________
(4)K2S2O8具有强氧化性,可通过电解H2SO4和K2SO4的混合溶液制得,其阳极反应式为_________,称取0.250 0 g 产品于碘量瓶中,加100 mL水溶解,再加入8.000 g KI固体(稍过量),振荡使其充分反应;加入适量醋酸溶液酸化,以淀粉为指示剂,用 c mol/L的Na2S2O3标准液滴定至终点,消耗Na2S2O3标准液V mL,则样品中K2S2O8的纯度为________%(用含c、V的代数式表示,已知:S2O82-+2I-===2SO42-+I2 ;2S2O32-+I2===2S4O82-+2I- )。
【答案】CaSO3+2HCl===CaCl2+SO2↑+H2O 拔下分液漏斗颈部的塞子(或使分液漏斗瓶塞上的凹槽对准瓶颈的小孔),然后再旋转下部活塞 SO2通入次氯酸钙溶液发生氧化还原反应,不能证明强酸制备弱酸的原理,既无法比较亚硫酸与次氯酸酸性强弱 B E 除去HCl气体 D中品红不褪色,F中出现白色沉淀 2SO42--2e-===S2O82- 54cV
【解析】
(1)亚硫酸根与盐酸反应可生成二氧化硫;
(2)使分液漏斗中液体顺利流下,应使分液漏斗内外压强相等;
(3)①次氯酸与二氧化硫之间发生氧化还原反应;
②根据反应中可能混有HCl,之后含有SO2造成干扰,故需依次除去;
(4)可利用反应物之间关系式S2O82-~2S2O32-计算。
(1)盐酸与亚硫酸钙反应生成氯化钙、二氧化硫与水,反应方程式为CaSO3+2HCl===CaCl2+SO2↑+H2O;
(2)分液漏斗使用时应使内外压强平衡,故操作为:拔下分液漏斗颈部的塞子(或使分液漏斗瓶塞上的凹槽对准瓶颈的小孔),然后再旋转下部活塞;
(3)①次氯酸具有强氧化性、二氧化硫具有还原性,两者可发生氧化还原反应;
②A装置制备二氧化硫,由于盐酸易挥发,制备的二氧化硫中混有HCl,用饱和的亚硫酸氢钠除去HCl,再通过碳酸氢钠溶液,可以验证亚硫酸酸性比碳酸强,用酸性高锰酸钾溶液氧化除去二氧化碳中的二氧化硫,用品红溶液检验二氧化碳中二氧化硫是否除尽,再通入F中,则:装置连接顺序为A、C、B、E、D、F,其中装置C的作用是除去HCl气体,D中品红不褪色,F中出现白色沉淀,可证明亚硫酸的酸性强于次氯酸;
(4)阳极硫酸根离子失电子,化合价升高,对应电极反应为2SO42--2e-= S2O82-; 由关系式可知S2O82-~2S2O32-,则样品中K2S2O8的纯度为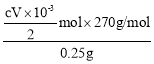 ×100%=54cV %。
×100%=54cV %。


科目:高中化学 来源: 题型:
【题目】![]() 定温度下,下列溶液的离子浓度关系式正确的是
定温度下,下列溶液的离子浓度关系式正确的是![]()
A.![]() 的
的![]() 溶液中,
溶液中,![]()
B.稀释氨水溶液10倍后,其![]() 为原來的
为原來的![]()
C.pH之和为14的![]() 与NaOH溶液混合:
与NaOH溶液混合:![]()
D.将等物质的量的![]() 和
和![]() 混合溶于水中:
混合溶于水中:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醛在一定条件下可以两分子加成:RCH2CHO+RCH2CHO![]()
![]() ,加成产物不稳定,受热即脱水而生成不饱和醛:
,加成产物不稳定,受热即脱水而生成不饱和醛:![]()
![]()
![]() +H2O。已知物质B是一种可作为药物的芳香族化合物,请根据如图(所有无机产物已略去)中各有机物的转化关系回答问题:
+H2O。已知物质B是一种可作为药物的芳香族化合物,请根据如图(所有无机产物已略去)中各有机物的转化关系回答问题:

(1)物质B所含官能团的名称 ______,B结构简式为 ______;
(2)物质A的核磁共振氢谱有 ______个峰。
(3)写出E→F的化学方程式 ______。
(4)写出G与D反应生成H的化学方程式 ______。
(5)F若与H2发生加反应,1molF最多消耗的H2的物质的量为______mol。
(6)芳香族化合物M与B互为同分异构体,且含有相同的官能团,试写出所有M结构简式 ____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年2月16日李克强总理到东北调研经济情况,重点走访了钢铁厂,鼓励钢铁厂提高钢铁质量和产量,铁及其化合物在日常生活中应用广泛。
(1)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理。已知含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4 H+=4Fe3++2H2O,则另一反应的离子方程式为__________;
(2)氧化铁是重要工业颜料,下面是制备氧化铁的一种方法,其流程如下:

①操作Ⅰ的名称是__________;操作Ⅱ为洗涤,洗涤操作的具体方法为__________;
②滤液A中加入稍过量的NH4HCO3溶液生成沉淀同时有一种气体产生,写出其化学方程式: __________;
(3)如果煅烧不充分,产品中将有FeO存在,称取3.0 g氧化铁产品,溶解,在250 mL容量瓶中定容;量取25.00 mL待测溶液于锥形瓶中,用酸化的0.01000 mol/L KMnO4溶液滴定至终点,重复滴定2-3次,消耗KMnO4溶液体积的平均值为20.00 mL,
①该实验中的KMnO4溶液需要酸化,用于酸化的酸是__________(填字母序号)。
a.稀硝酸 b.稀盐酸 c.稀硫酸 d.浓硝酸
②计算上述产品中Fe2O3的质量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖酸亚铁[(C6H11O7)2Fe]是医疗上常用的补铁剂,易溶于水,几乎不溶于乙醇。某实验小组同学拟用下图装置先制备FeCO3,再用FeCO3与葡萄糖酸反应进一步制得葡萄糖酸亚铁。
请回答下列问题:
(1)与普通漏斗比较,a漏斗的优点是___。
(2)按如图连接好装置,检査气密性后加入药品,打开K1和K3,关闭K2。
①b中的实验现象___。
②一段时间后,关闭___,打开___(选填“K1”“K2”或“K3”),观察到b中的溶液会流入c中,同时c中析出FeCO3沉淀。
③b中产生的气体的作用是___。
(3)将c中制得的碳酸亚铁在空气中过滤时间较长时,表面会变为红褐色,用化学方程式说明其原因:___。
(4)将葡萄糖酸与碳酸亚铁混合,须将溶液的pH调节至5.8,其原因是___。向上述溶液中加入乙醇即可析出产品,加入乙醇的目的是___。
(5)有同学提出用NaHCO3溶液代替Na2CO3溶液制得的碳酸亚铁纯度更高,其可能的原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下X、Y、Z、W、R五种元素均为短周期元素,它们的化合价与原子序数的关系如图,下列说法正确

A.简单离子的半径: Y>Z>X
B.最高价氧化物对应水化物的酸性: R>W
C.单质的还原性: Z>Y
D.简单氢化物的沸点: W>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O ![]() Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是( )
Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是( )
A.放电时负极得电子,质量减轻
B.放电时负极附近的pH增大
C.充电时该电池的正极与外加电源的负极相连
D.充电时阳极反应:Ni(OH)2-e-+OH-=NiOOH+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。有关物质的部分性质如下表:

实验室用干燥而纯浄的二氧化硫和氯气合成硫酰氯,反应的热化学方程式为:SO2(g)+Cl2(g)![]() SO2Cl2(l) △H=-97.3 kJ· mol-1
SO2Cl2(l) △H=-97.3 kJ· mol-1
反应装置如图所示(夹持仪器已省略),请回答有关问题:

(1)仪器B的名称为________;
(2)仪器A的作用是_______;
(3)装置乙中盛放的试剂为______,在实验室用氢氧化钠溶液吸收多余硫酰氯的离子反应方程式为______;
(4)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有_______(填序号);
①先通冷凝水,再通气体 ②控制气流速率,宜慢不宜快
③若三颈烧瓶发烫,可适当降温 ④加热三颈烧瓶
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H=H2SO4+SO2Cl2,此方法得到的产品中会混有硫酸。
①分解产物中分离出硫酰氯的实验操作名称为____。
②某同学为检验硫酰氯产品中是否混有硫酸设计实验如下:取少量产品溶于水,加入盐酸酸化的氯化钡溶液,振荡,观察到有白色沉淀生成,则认为产品中含有硫酸。该同学的结论是否正确,请说明理由____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为不同化学元素组成的化合物示意图,下列说法正确的是( )
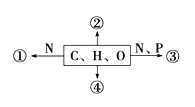
A. 若图中①为某种化合物的基本单位,则①最可能是核苷酸
B. 若②广泛分布在动物细胞内,则其一定是糖原
C. 若③为生物大分子,则其彻底水解产物最多为4种
D. 若④为重要储能物质,则动物和植物细胞都含有这种物质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com