
【题目】![]() 定温度下,下列溶液的离子浓度关系式正确的是
定温度下,下列溶液的离子浓度关系式正确的是![]()
A.![]() 的
的![]() 溶液中,
溶液中,![]()
B.稀释氨水溶液10倍后,其![]() 为原來的
为原來的![]()
C.pH之和为14的![]() 与NaOH溶液混合:
与NaOH溶液混合:![]()
D.将等物质的量的![]() 和
和![]() 混合溶于水中:
混合溶于水中:
【答案】D
【解析】
A.根据硫化氢溶液中的电离平衡![]() 、
、![]() 、
、![]() 判断;
判断;
B.一水合氨为弱碱,弱碱在稀释过程中溶液中的氢氧根离子浓度变化比强碱溶液小;
C.pH之和为14的![]() 与NaOH溶液混合溶液中存在电荷守恒;
与NaOH溶液混合溶液中存在电荷守恒;
D.将等物质的量的![]() 和
和![]() 混合溶于水中,碳酸根离子水解程度大于碳酸氢根离子。
混合溶于水中,碳酸根离子水解程度大于碳酸氢根离子。
![]() 溶液中存在电离平衡:
溶液中存在电离平衡:![]() 、
、![]() 、
、![]() ,根据上述反应知,氢离子来自水的电离和硫化氢的电离,则
,根据上述反应知,氢离子来自水的电离和硫化氢的电离,则![]() 的
的![]() 溶液中,
溶液中,![]()
![]() ,故A错误;
,故A错误;
B.一水合氨为弱电解质,加水稀释后促进了其电离,溶液中的氢氧根离子浓度变化比强碱溶液小,其![]() 比原來的
比原來的![]() 大,故B错误;
大,故B错误;
C.pH之和为14的![]() 与NaOH溶液混合,溶液中电荷守恒为:
与NaOH溶液混合,溶液中电荷守恒为:![]() ,故C错误;
,故C错误;
D.碳酸根离子水解程度大于碳酸氢根离子,将等物质的量的![]() 和
和![]() 混合溶于水中
混合溶于水中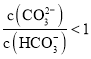 ,故D正确;
,故D正确;
故选:D。


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大。其中X与Y可形成一种淡黄色物质P,常温下将0.05 mol P溶于水,配成1 L溶液,其中![]() ;Z为金属元素,且Z可在W的一种氧化物中燃烧,生成一种白色的物质和一种黑色的物质。下列说法错误的是()
;Z为金属元素,且Z可在W的一种氧化物中燃烧,生成一种白色的物质和一种黑色的物质。下列说法错误的是()
A. 氢化物的沸点:W<X
B. 简单离子半径:X>Y>Z
C. 化合物P中既含有离子键又含有共价键
D. W、X、Y三种元素形成的物质的水溶液显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年12月以来,我国武汉等地相继暴发了新冠肺炎,为此我国政府和相关部门采取了多项措施控制疫情。75%乙醇和84消毒液等均能有效灭活新冠病毒。84消毒液的主要成分是次氯酸钠。设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.74.5g次氯酸钠中含有的离子数目为2NA
B.1mol次氯酸钠与足量盐酸反应转移的电子数为2NA
C.46g75%乙醇中含有的氧原子数大于6NA
D.利用氯气和氢氧化钠溶液反应制取0.1mol次氯酸钠需要消耗2.24L氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有:H、C、O、S、Cl、Fe六种元素,则回答下列有关其性质:
![]() 原子价电子的排布为 ______ ;Cl位于周期表中位置: ______ ;C原子核外有 ______ 个能级。
原子价电子的排布为 ______ ;Cl位于周期表中位置: ______ ;C原子核外有 ______ 个能级。
![]() 用“
用“![]() ”或“
”或“![]() ”填空:还原性:HCl ______
”填空:还原性:HCl ______ ![]() ,半径:C ______ O
,半径:C ______ O
![]() 在NaOH溶液中用Fe作阳极,通过电解制取
在NaOH溶液中用Fe作阳极,通过电解制取![]() 的电极反应式为: ______
的电极反应式为: ______
![]() 已知1molS完全燃烧生成
已知1molS完全燃烧生成![]() 放出akJ热量;又知
放出akJ热量;又知![]() ;
;![]() ;则请写出1mol固体S生成气体
;则请写出1mol固体S生成气体![]() 的热化学方程式为 ______
的热化学方程式为 ______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酯类物质M是一种药物的主要合成中间体,其合成路线如下:

已知以下信息:
①芳香烃A的相对分子质量在100~110之间,1molA完全燃烧可消耗10molO2。
②H的核磁共振氢谱显示其有3种氢。
③RCH=CH2![]() RCHClCH3
RCHClCH3
④RX+Mg![]() RMgX(X代表卤素)
RMgX(X代表卤素)
⑤
![]()


回答下列问题:
(1)A的结构简式为______,H中官能团的名称为______。
(2)由E和H生成M的化学方程式为______。
(3)属于氧化反应的是______(填序号)。
(4)同时符合下列条件的E的同分异构体有______种(不考虑立体异构),其中苯环上一氯代物只有两种的结构简式为______。(任写一种)
①能与碳酸钠溶液发生反应;②苯环上的取代基数目有2个
(5)请结合所给信息,由苯合成苯乙烯,合成路线如图所示,请回答下列问题。

试剂②为______,最后一步反应的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,对于①![]()
![]() 溶液②
溶液②![]() 的HCl溶液③
的HCl溶液③![]() 的NaOH溶液④
的NaOH溶液④![]()
![]() 溶液,下列说法正确的是
溶液,下列说法正确的是![]()
A.①和②分别稀释100倍后的pH:②<①
B.水电离出的![]() :④>③>②>①
:④>③>②>①
C.①和③混合后溶液呈中性: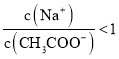
D.①和④混合后溶液呈酸性: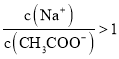
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能源是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙。将6.00g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72LH2(已折算成标准状况),甲与水反应也能产生H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状态下的密度为1.25g/L。请回答下列问题:
(1)甲的化学式是__________;乙的电子式是__________。
(2)甲与水反应的化学方程式是__________。
(3)气体丙与金属镁反应的产物是__________(用化学式表示)。
(4)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式__________。有人提出产物Cu中可能还含有Cu2O,请设计实验方案验证之__________(已知Cu2O+2H+=Cu+Cu2++H2O)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尿素[CO(NH2)2]是首个由无机物人工合成的有机物。工业上合成尿素的反应如下:2NH3(g)+CO2(g) ![]() CO(NH2)2(l)+H2O(l) △H<0。回答下列问题:
CO(NH2)2(l)+H2O(l) △H<0。回答下列问题:
(1)已知工业上合成尿素分两步进行,相关反应如下:
反应Ⅰ:2NH3(g)+CO2(g) ![]() NH2COONH4(s) △H1<0
NH2COONH4(s) △H1<0
反应Ⅱ:NH2COONH4(s) ![]() CO(NH2)2(l)+H2O(l) △H2>0
CO(NH2)2(l)+H2O(l) △H2>0
①△H=________________(用△H1、△H2表示)
②下列示意图中[a表示2NH3(g)+CO2(g),b表示NH2COONH4(s),c表示CO(NH2)2(l)+H2O(l)],能正确表示尿素合成过程中能量变化曲线是(填编号)______。
(2)某实验小组模拟工业上合成尿素的条件,在恒定温度下,将氨气和二氧化碳按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质浓度的变化曲线如下图所示。

①可以判断该化合反应已经达到化学平衡的是_________。(填编号)
A.![]() B.密闭容器中总压强不变
B.密闭容器中总压强不变
C.密闭容器中氨气的体积分数不变 D.密闭容器中混合气体的密度不变
②在上述条件下,从反应开始至20min时,二氧化碳的平均反应速率为____________。
③该反应的平衡常数表达式K=____________。
(3)人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如下图所示。

阳极室中发生的反应依次为_____________________、____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫是一种自然界分布较广的元素,在很多化合物中都含有该元素,回答下列问题:

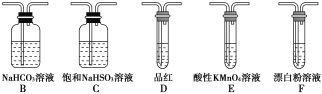
(1)装置A中反应的化学方程式为______________________________________。
(2)使分液漏斗中液体顺利流下的操作是_________________________。
(3)选用上面的装置和药品探究亚硫酸与次氯酸的酸性强弱:
①甲同学认为按照A→C→F的顺序连接装置即可证明,乙同学认为该方案不合理,其理由是_________
②丙同学设计的合理实验方案为A→C→________→________→D→F,其中装置C的作用是______,证明亚硫酸的酸性强于次氯酸的实验现象是____________
(4)K2S2O8具有强氧化性,可通过电解H2SO4和K2SO4的混合溶液制得,其阳极反应式为_________,称取0.250 0 g 产品于碘量瓶中,加100 mL水溶解,再加入8.000 g KI固体(稍过量),振荡使其充分反应;加入适量醋酸溶液酸化,以淀粉为指示剂,用 c mol/L的Na2S2O3标准液滴定至终点,消耗Na2S2O3标准液V mL,则样品中K2S2O8的纯度为________%(用含c、V的代数式表示,已知:S2O82-+2I-===2SO42-+I2 ;2S2O32-+I2===2S4O82-+2I- )。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com