
【题目】已知有:H、C、O、S、Cl、Fe六种元素,则回答下列有关其性质:
![]() 原子价电子的排布为 ______ ;Cl位于周期表中位置: ______ ;C原子核外有 ______ 个能级。
原子价电子的排布为 ______ ;Cl位于周期表中位置: ______ ;C原子核外有 ______ 个能级。
![]() 用“
用“![]() ”或“
”或“![]() ”填空:还原性:HCl ______
”填空:还原性:HCl ______ ![]() ,半径:C ______ O
,半径:C ______ O
![]() 在NaOH溶液中用Fe作阳极,通过电解制取
在NaOH溶液中用Fe作阳极,通过电解制取![]() 的电极反应式为: ______
的电极反应式为: ______
![]() 已知1molS完全燃烧生成
已知1molS完全燃烧生成![]() 放出akJ热量;又知
放出akJ热量;又知![]() ;
;![]() ;则请写出1mol固体S生成气体
;则请写出1mol固体S生成气体![]() 的热化学方程式为 ______
的热化学方程式为 ______
【答案】![]() 第三周期第VIIA族 3
第三周期第VIIA族 3 ![]()
![]()
![]()
![]()
【解析】
![]() 为26号元素,位于第四周期第VIII族,价电子排布为:
为26号元素,位于第四周期第VIII族,价电子排布为:![]() ,Cl处于第三周期第VIIA族,C原子序数为6,分别是1s、2s和2p。
,Cl处于第三周期第VIIA族,C原子序数为6,分别是1s、2s和2p。
![]() 与S处于同一周期,原子序数越大,非金属性越强,氢化物还原性越弱。
与S处于同一周期,原子序数越大,非金属性越强,氢化物还原性越弱。
![]() 用电化学法制取
用电化学法制取![]() ,由图可知Fe为阳极失去电子,由此得出阳极反应式。
,由图可知Fe为阳极失去电子,由此得出阳极反应式。
![]() 依据已知信息书写两个热化学方程式如下:
依据已知信息书写两个热化学方程式如下:![]() ,
,![]() ;则利用盖斯定律,将
;则利用盖斯定律,将![]() 可得1mol固体S生成气体
可得1mol固体S生成气体![]() 的热化学方程式。
的热化学方程式。
![]() 为26号元素,位于第四周期第VIII族,价电子排布为:
为26号元素,位于第四周期第VIII族,价电子排布为:![]() ,Cl处于第三周期第VIIA族,C原子序数为6,有3个能级,分别是1s、2s和2p。答案为:
,Cl处于第三周期第VIIA族,C原子序数为6,有3个能级,分别是1s、2s和2p。答案为:![]() ;第三周期第VIIA族;3;
;第三周期第VIIA族;3;
![]() 与S处于同一周期,原子序数越大,非金属性越强,氢化物还原性越弱,故还原性
与S处于同一周期,原子序数越大,非金属性越强,氢化物还原性越弱,故还原性![]() ,原子序数
,原子序数![]() ,故半径
,故半径![]() 。答案为:
。答案为:![]() ;
;![]() ;
;
![]() 用电化学法制取
用电化学法制取![]() ,由图可知Fe为阳极失去电子,则阳极反应为
,由图可知Fe为阳极失去电子,则阳极反应为![]() 。答案为:
。答案为:![]() ;
;
![]() 已知
已知![]() ,
,![]() ;则利用盖斯定律,将
;则利用盖斯定律,将![]() 可得
可得![]() 。答案为:
。答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】某温度下,0.200 molL-1的HA溶液与0.200 molL-1的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如下表,下列说法正确的是
微粒 | X | Y | Na+ | A- |
浓度/(mol·L-1) | 8.00 | 2.50 | 0.100 | 9.92 |
A. 0.1mol·L-1HA溶液的pH=1 B. 该温度下Kw=1.0![]() 10-14
10-14
C. 微粒X表示OH-,Y表示H+ D. 混合溶液中:n(A-)+n(X)=n(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4molA气体和2molB气体在2L的容器中发生如下反应:2A(g)+B(g)![]() 2C(g)。若经2s后测得C的浓度为0.6mol/L,现有下列几种说法,其中正确的是
2C(g)。若经2s后测得C的浓度为0.6mol/L,现有下列几种说法,其中正确的是
①用物质A表示的反应的平均速率为0.3mol/(L.s)
②用物质B表示的反应的平均速率为0.6mol/(L.s)
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7mol/L
A.①③B.②④C.①④D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素 a~g 在表中的位置如右表,请回答下列问题:
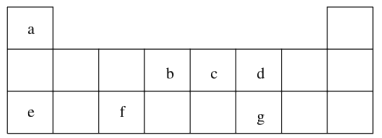
(1)d、e元素常见离子的半径由大到小的顺序为(用化学式表示)__________;b、c两元素非金属性较强的是(写元素符号)_________,写出能证明这一结论的一个化学方程式_____________。
(2)下列有关说法正确的是(___)
A.e在 d2 中燃烧,生成e2d
B.加热熔化eda时不可用Al2O3坩埚,可用瓷坩埚
C.将 gd2 通入溴水中,溴水褪色,体现了gd2 的漂白性
D.将打磨过的 f 置于酒精灯上点燃,观察到f 熔化但未见液滴滴落
(3)上述元素可组成盐 R:ca4f(gd4)2和盐S:ca4agd4。
①相同条件下,0.1 mol·L-1盐R中 c(ca4+) _______(填“=”、 “>”或“<”)0.1 mol·L-1盐S中c(ca4+)。
②R常用作净水剂,其原理为(用离子方程式表示)______________。
③向盛有 10 mL 1 mol·L-1盐S溶液的烧杯中滴加1 mol·L-1 NaOH溶液至中性,则反应后各离子浓度由大到小的排列顺序是_____________。
④向盛有 10 mL 1 mol·L-1盐R溶液的烧杯中滴加 1 mol·L-1NaOH溶液 32 mL后,继续滴加至35 mL,写出此时段(32 mL~35 mL)间发生的离子方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图象正确的是( )
A. 向 Ca(OH)2和 NaOH的混合溶液中通 入CO2
B. 向 FeCl3 溶液中加入锌粉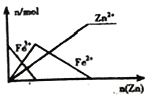
C. 向 NaOH 溶液中通入CO2
D. HCl与Cl2的混合气体通入NaOH溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列说法正确的是![]()
A.将![]() 的盐酸和
的盐酸和![]() 的硫酸等体积混合,所得溶液
的硫酸等体积混合,所得溶液![]()
B.HF比HCN易电离,则NaF溶液的pH比同浓度NaCN溶液的pH大
C.向![]()
![]() 氨水中加入少量硫酸铵固体,溶液中
氨水中加入少量硫酸铵固体,溶液中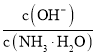 增大
增大
D.将1mL![]() 的HA溶液稀释到10mL,若溶液的
的HA溶液稀释到10mL,若溶液的![]() ,则HA为弱酸
,则HA为弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 定温度下,下列溶液的离子浓度关系式正确的是
定温度下,下列溶液的离子浓度关系式正确的是![]()
A.![]() 的
的![]() 溶液中,
溶液中,![]()
B.稀释氨水溶液10倍后,其![]() 为原來的
为原來的![]()
C.pH之和为14的![]() 与NaOH溶液混合:
与NaOH溶液混合:![]()
D.将等物质的量的![]() 和
和![]() 混合溶于水中:
混合溶于水中:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生反应3A(g)+B(g)xC(g)+2D(g),经5s后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,v(C)为0.1mol/(L·s)
求:(1)x的值;___________
(2)以B表示的该反应的平均反应速率;___________
(3)此时A的浓度及反应开始前放入容器中的A、B的物质的量。___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年2月16日李克强总理到东北调研经济情况,重点走访了钢铁厂,鼓励钢铁厂提高钢铁质量和产量,铁及其化合物在日常生活中应用广泛。
(1)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理。已知含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4 H+=4Fe3++2H2O,则另一反应的离子方程式为__________;
(2)氧化铁是重要工业颜料,下面是制备氧化铁的一种方法,其流程如下:

①操作Ⅰ的名称是__________;操作Ⅱ为洗涤,洗涤操作的具体方法为__________;
②滤液A中加入稍过量的NH4HCO3溶液生成沉淀同时有一种气体产生,写出其化学方程式: __________;
(3)如果煅烧不充分,产品中将有FeO存在,称取3.0 g氧化铁产品,溶解,在250 mL容量瓶中定容;量取25.00 mL待测溶液于锥形瓶中,用酸化的0.01000 mol/L KMnO4溶液滴定至终点,重复滴定2-3次,消耗KMnO4溶液体积的平均值为20.00 mL,
①该实验中的KMnO4溶液需要酸化,用于酸化的酸是__________(填字母序号)。
a.稀硝酸 b.稀盐酸 c.稀硫酸 d.浓硝酸
②计算上述产品中Fe2O3的质量分数为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com