
����Ŀ��������Ԫ�� a��g �ڱ��е�λ�����ұ�����ش��������⣺
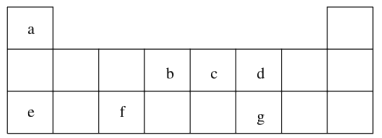
��1��d��eԪ�س������ӵİ뾶�ɴ�С��˳��Ϊ(�û�ѧʽ��ʾ)__________��b��c��Ԫ�طǽ����Խ�ǿ����(дԪ�ط���)_________��д����֤����һ���۵�һ����ѧ����ʽ_____________��
��2�������й�˵����ȷ������___��
A��e�� d2 ��ȼ�գ�����e2d
B�������ۻ�edaʱ������Al2O3���������ô�����
C���� gd2 ͨ����ˮ�У���ˮ��ɫ��������gd2 ��Ư����
D������ĥ���� f ���ھƾ����ϵ�ȼ���۲쵽f �ۻ���δ��Һ�ε���
��3������Ԫ�ؿ������ R��ca4f(gd4)2����S��ca4agd4��
����ͬ�����£�0.1 mol��L��1��R�� c(ca4��) _______(����=���� ��>������<��)0.1 mol��L-1��S��c(ca4��)��
��R��������ˮ������ԭ��Ϊ�������ӷ���ʽ��ʾ��______________��
����ʢ�� 10 mL 1 mol��L-1��S��Һ���ձ��еμ�1 mol��L-1 NaOH��Һ�����ԣ���Ӧ�������Ũ���ɴ�С������˳����_____________��
����ʢ�� 10 mL 1 mol��L-1��R��Һ���ձ��еμ� 1 mol��L-1NaOH��Һ 32 mL�����μ���35 mL��д����ʱ��(32 mL��35 mL)�䷢�������ӷ���ʽ��_____________��
���𰸡� O2��>Na�� N 2HNO3��Na2CO3=2NaNO3��CO2����H2O D < Al3++3H2O![]() Al(OH)3(����) + 3H+ c(Na��)��c(SO42��)��c(NH4��)��c(OH��)��c(H��) NH4����OH��===NH3��H2O
Al(OH)3(����) + 3H+ c(Na��)��c(SO42��)��c(NH4��)��c(OH��)��c(H��) NH4����OH��===NH3��H2O
����������Ԫ�������ڱ���λ�ÿ�֪��aΪH��bΪC��cΪN��dΪO��eΪNa��fΪAl��gΪS��
��1�����Ӳ�ṹ��ͬ�����ӣ��˵����Խ�����Ӱ뾶ԽС�������Ӱ뾶��O2-��Na+��
ͬ�����������Ԫ�طǽ�������ǿ���ʷǽ�����N��C������������ۺ�������ǿ���Ʊ����������֤����Ӧ����ʽΪ��2HNO3+Na2CO3 =2NaNO3+CO2��+H2O����
��2��A��Na��O2 ��ȼ�գ����ɻ�ɫ��ĩNa2O2����A����B���ڼ����ۻ�״̬�£�NaOH����Al2O3��SiO2��Ӧ�����κ�ˮ��������ۻ�NaOHʱ������Al2O3������Ҳ�����ô���������B����C���� SO2 ͨ����ˮ�У���ˮ��ɫ������SO2 �Ļ�ԭ�ԣ�������Ư���ԣ���C����D����ĥ����Al���ھƾ����ϵ�ȼ�������������������������������������۵��Al�ߣ���۲쵽Al�ۻ���δ��Һ�ε��䣬��D��ȷ����ΪD��
��3����NH4Al��SO4��2��Һ��笠������������������ˮ�⣬��NH4HSO4��Һ������������笠�����ˮ�⣬���������Ƴ̶Ȳ���������Ƴ̶ȴ���NH4HSO4��Һ��笠�����Ũ�ȸ�����ͬ�����£�0.1 mol��L��1��NH4Al��SO4��2�� c(NH4��) <0.1 mol��L-1��NH4HSO4��c(NH4��)��
��NH4Al��SO4��2��������ˮ��������ΪAl3+ˮ�����ɵ������������������������������Ӧ�����ӷ���ʽΪAl3++3H2O![]() Al(OH)3(����) + 3H+��
Al(OH)3(����) + 3H+��
��NH4HSO4�� NaOH�����ʵ���1��1��ӦʱΪ�����ơ�����炙����Һ����Һ�����ԣ�����ϳ����ԣ�����һˮ�ϰ����ɣ�Ϊ�����ơ�����李�һˮ�ϰ������Һ����Ӧ�������Ũ���ɴ�С������˳���ǣ�c��Na+����c��SO42-����c��NH4+����c��OH-��=c��H+����
��10mL 1molL-1 NH4Al��SO4��2��Һ��Al3+ ���ʵ���Ϊ0.01mol��NH4+�����ʵ���Ϊ0.01mol��SO42-�����ʵ���Ϊ0.02mol��32mL 1mol/L NaOH��Һ��NaOH���ʵ���Ϊ0.032L��1mol/L=0.032mol����Al3++3OH-=Al��OH��3������֪��ȫ��������������0.03mol NaOH������NaOH��Һ30mL����NH4++OH-=NH3H2O����֪笠�������ȫ��Ӧ����NaOHΪ0.01mol��������NaOH��Һ10mL���ʼ���32mLNOH��Һ�����μ���35mLʱ��Ӧ���ӷ���ʽΪ��NH4++OH-=NH3H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£����淴Ӧ2NO2![]() 2NO��O2������̶����ܱ������з�Ӧ���ﵽƽ��״̬�ı�־�ǣ� ��
2NO��O2������̶����ܱ������з�Ӧ���ﵽƽ��״̬�ı�־�ǣ� ��
�ٵ�λʱ��������n mol O2��ͬʱ����2n mol NO2
�ڵ�λʱ��������n mol O2��ͬʱ����2n mol NO
����NO2��NO��O2�����ʵ���Ũ�ȱ仯��ʾ�ķ�Ӧ���ʵı�Ϊ2:2:1
�ܻ�������ѹǿ���ٸı�
�ݻ���������ɫ���ٸı�
��������ƽ����Է����������ٸı�
A.�٢ܢݢ�B.�٢ڢۢ�C.�ڢۢܢ�D.����ȫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��Co��Cu��Zn���ǹ���Ԫ�أ�����Ϊ����ԭ���γɶ����������в�����Ϊ�������λ�����______��
A��H2O B��NH3 C��CH4 D��Cl��
��2���������ʾʽд����ˮ��NH3������ˮ���Ӽ���ܴ��ڵ����____��
��3��CuԪ�ؿ��γ�[Cu(NH3)4]SO4�����д��ڵĻ�ѧ��������______������ţ���
����λ���� ������� �ۼ��Թ��ۼ����ܷǼ��Թ��ۼ� �����Ӽ���
��4�����龧��ľ����ṹ����ͼ�������й�˵����ȷ����_______��
A�������ڳ����³���̬��˵�����龧�����ڷ��Ӿ���
B��������1��CH4������12�����ڵļ������
C��CH4�����ۻ�ʱ��˷����ۼ�

��5����ͼ��ʾ����SiO2�ľ����ṹ����Ȧ������ԭ�ӣ��ڵ������ԭ�ӣ����ж���30g�������辧���к�______mol Si��O���������������ı߳�Ϊa cm����NA ��ʾ�����ӵ���������SiO2������ܶȱ���ʽΪ__________________g/cm3 ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����30 mL 1 mol��L��1��AlCl3��Һ������Ũ��Ϊ4 mol��L��1��NaOH��Һ��������0.78 g��ɫ������������NaOH��Һ���������Ϊ(����)
A.3 mLB.7.5 mLC.15 mLD.17.5 mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2019��12���������ҹ��人�ȵ���̱������¹ڷ��ף�Ϊ���ҹ���������ز��Ų�ȡ�˶����ʩ�������顣75%�Ҵ���84����Һ�Ⱦ�����Ч����¹ڲ�����84����Һ����Ҫ�ɷ��Ǵ������ơ���NAΪ�����ӵ�������ֵ������˵����ȷ���ǣ�������
A.74.5g���������к��е�������ĿΪ2NA
B.1mol�����������������ᷴӦת�Ƶĵ�����Ϊ2NA
C.46g75%�Ҵ��к��е���ԭ��������6NA
D.��������������������Һ��Ӧ��ȡ0.1mol����������Ҫ����2.24L����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʹ�������ǿ����������ܵ���Ҫ�о�����
��1��Ti��BH4��3��һ�ִ�����ϣ�����TiCl4��LiBH4��Ӧ�Ƶã�
����̬Clԭ���У�����ռ�ݵ�����ܲ����Ϊ_____�����ܲ���е�ԭ�ӹ����Ϊ_____��
��LiBH4��Li+��BH4�����ɣ�BH4��������ṹ��_____��Bԭ�ӵ��ӻ����������_____��
Li��B��HԪ�صĵ縺���ɴ�С����˳��Ϊ_____��
��2�������⻯���Ǿ������÷�չǰ���Ĵ�����ϣ�
��LiH�У����Ӱ뾶Li+_____H����������������=����������������ij��������ǵ������ڽ���Ԫ��M���⻯�M�IJ��ֵ����������ʾ��
I1/kJmol��1 | I2/kJmol��1 | I3/kJmol��1 | I4/kJmol��1 | I5/kJmol��1 |
738 | 1451 | 7733 | 10540 | 13630 |
M��_____����Ԫ�ط��ţ���
��3��NaH����NaCl�;���ṹ����֪NaH����ľ�������a=488pm���ⳤ����Na+�뾶Ϊ102pm��H���İ뾶Ϊ_____��NaH�������ܶ���___________gcm��3��ֻ����ʽ�����ؼ������ֵ�������ӵ�����ΪNA��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�У�H��C��O��S��Cl��Fe����Ԫ�أ���ش������й������ʣ�
![]() ԭ�Ӽ۵��ӵ��Ų�Ϊ ______ ��Clλ�����ڱ���λ�ã� ______ ��Cԭ�Ӻ����� ______ ���ܼ���
ԭ�Ӽ۵��ӵ��Ų�Ϊ ______ ��Clλ�����ڱ���λ�ã� ______ ��Cԭ�Ӻ����� ______ ���ܼ���
![]() �á�
�á�![]() ����
����![]() ����գ���ԭ�ԣ�HCl ______
����գ���ԭ�ԣ�HCl ______ ![]() ���뾶��C ______ O
���뾶��C ______ O
![]() ��NaOH��Һ����Fe��������ͨ�������ȡ
��NaOH��Һ����Fe��������ͨ�������ȡ![]() �ĵ缫��ӦʽΪ�� ______
�ĵ缫��ӦʽΪ�� ______
![]() ��֪1molS��ȫȼ������
��֪1molS��ȫȼ������![]() �ų�akJ��������֪
�ų�akJ��������֪![]() ��
��![]() �������1mol����S��������
������д��1mol����S��������![]() ���Ȼ�ѧ����ʽΪ ______
���Ȼ�ѧ����ʽΪ ______
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����ڢ�![]()
![]() ��Һ��
��Һ��![]() ��HCl��Һ��
��HCl��Һ��![]() ��NaOH��Һ��
��NaOH��Һ��![]()
![]() ��Һ������˵����ȷ����
��Һ������˵����ȷ����![]()
A.�ٺ͢ڷֱ�ϡ��100�����pH���ڣ���
B.ˮ�������![]() ���ܣ��ۣ��ڣ���
���ܣ��ۣ��ڣ���
C.�ٺ͢ۻ�Ϻ���Һ�����ԣ�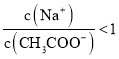
D.�ٺܻ͢�Ϻ���Һ�����ԣ�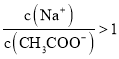
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���۱���ϩ(PS)�;۶Ա��������Ҷ�����(PET)���Ͼ��и����ԡ����ᡢ���������ܣ�������������Ӧ�ù㷺�������־ۺ���ɰ���ͼ·�ߺϳɣ���ش��������⣺

(1)A�ķ���ʽΪ______����˴Ź���������______��(��)���շ塣
(2)���б�����B��ͬ���칹����______�֡�
(3)DΪ����ϩ����ṹ��ʽΪ______��������Ϊ______��
(4)F������Ϊ______����E��G�ķ�Ӧ������______(����ۡ��Ӿۡ�)��Ӧ��
(5)��֪��
![]()
![]()
![]()
![]()
![]()
д����BrCH2CH2Br�Ʊ�HOOC-CH2CH2-COOH�ĺϳ�·�ߣ�______��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com