
【题目】常温下,对于①![]()
![]() 溶液②
溶液②![]() 的HCl溶液③
的HCl溶液③![]() 的NaOH溶液④
的NaOH溶液④![]()
![]() 溶液,下列说法正确的是
溶液,下列说法正确的是![]()
A.①和②分别稀释100倍后的pH:②<①
B.水电离出的![]() :④>③>②>①
:④>③>②>①
C.①和③混合后溶液呈中性: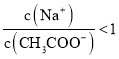
D.①和④混合后溶液呈酸性: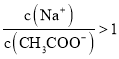
【答案】A
【解析】
A.醋酸是弱电解质,氯化氢是强电解质,等物质的量浓度的盐酸和醋酸,盐酸的pH小于醋酸;
B.酸或碱抑制水电离,含有弱根离子的盐促进水电离;
C.溶液呈中性,则![]() ,根据电荷守恒判断;
,根据电荷守恒判断;
D.溶液呈酸性,则![]() ,根据电荷守恒判断。
,根据电荷守恒判断。
![]() 醋酸是弱电解质,氯化氢是强电解质,常温下,
醋酸是弱电解质,氯化氢是强电解质,常温下,![]() 的HCl溶液中
的HCl溶液中![]() ,醋酸和盐酸的物质的量浓度相等,稀释相同倍数后,盐酸中氢离子浓度大于醋酸中氢离子浓度,则盐酸的pH小于醋酸,故A正确;
,醋酸和盐酸的物质的量浓度相等,稀释相同倍数后,盐酸中氢离子浓度大于醋酸中氢离子浓度,则盐酸的pH小于醋酸,故A正确;
B.酸或碱抑制水电离,含有弱根离子的盐促进水电离,醋酸是弱电解质,氯化氢是强电解质,所以相同物质的量浓度的醋酸和盐酸,盐酸中水电离出的氢氧根离子浓度小于醋酸,所以水电离出氢氧根离子浓度大小顺序是![]() ,故B错误;
,故B错误;
C.溶液呈中性,则![]() ,根据电荷守恒得
,根据电荷守恒得![]() ,故C错误;
,故C错误;
D.溶液呈酸性,则![]() ,根据电荷守恒得
,根据电荷守恒得![]() ,故D错误;
,故D错误;
故选A。


科目:高中化学 来源: 题型:
【题目】已知可分别通过如下两个反应制取氢气: ( )
a.CH3CH2OH(g)+H2O(g) ![]() 4H2(g)+2CO(g) ΔH=+256.6 kJ·mol-1
4H2(g)+2CO(g) ΔH=+256.6 kJ·mol-1
b.2CH3CH2OH(g)+O2(g) ![]() 6H2(g)+4CO(g) ΔH=+27.6 kJ·mol-1
6H2(g)+4CO(g) ΔH=+27.6 kJ·mol-1
则下列说法正确的是( )
A.乙醇的燃烧热ΔH=-13.8 kJ·mol-1
B.升高反应a的反应温度,乙醇的转化率减小
C.2H2(g)+O2(g)=2H2O(g) ΔH=-229 kJ·mol-1
D.制取等量的氢气,反应b吸收的能量更少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素 a~g 在表中的位置如右表,请回答下列问题:
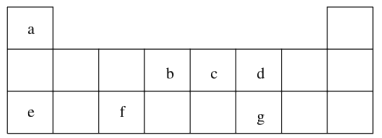
(1)d、e元素常见离子的半径由大到小的顺序为(用化学式表示)__________;b、c两元素非金属性较强的是(写元素符号)_________,写出能证明这一结论的一个化学方程式_____________。
(2)下列有关说法正确的是(___)
A.e在 d2 中燃烧,生成e2d
B.加热熔化eda时不可用Al2O3坩埚,可用瓷坩埚
C.将 gd2 通入溴水中,溴水褪色,体现了gd2 的漂白性
D.将打磨过的 f 置于酒精灯上点燃,观察到f 熔化但未见液滴滴落
(3)上述元素可组成盐 R:ca4f(gd4)2和盐S:ca4agd4。
①相同条件下,0.1 mol·L-1盐R中 c(ca4+) _______(填“=”、 “>”或“<”)0.1 mol·L-1盐S中c(ca4+)。
②R常用作净水剂,其原理为(用离子方程式表示)______________。
③向盛有 10 mL 1 mol·L-1盐S溶液的烧杯中滴加1 mol·L-1 NaOH溶液至中性,则反应后各离子浓度由大到小的排列顺序是_____________。
④向盛有 10 mL 1 mol·L-1盐R溶液的烧杯中滴加 1 mol·L-1NaOH溶液 32 mL后,继续滴加至35 mL,写出此时段(32 mL~35 mL)间发生的离子方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列说法正确的是![]()
A.将![]() 的盐酸和
的盐酸和![]() 的硫酸等体积混合,所得溶液
的硫酸等体积混合,所得溶液![]()
B.HF比HCN易电离,则NaF溶液的pH比同浓度NaCN溶液的pH大
C.向![]()
![]() 氨水中加入少量硫酸铵固体,溶液中
氨水中加入少量硫酸铵固体,溶液中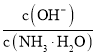 增大
增大
D.将1mL![]() 的HA溶液稀释到10mL,若溶液的
的HA溶液稀释到10mL,若溶液的![]() ,则HA为弱酸
,则HA为弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 定温度下,下列溶液的离子浓度关系式正确的是
定温度下,下列溶液的离子浓度关系式正确的是![]()
A.![]() 的
的![]() 溶液中,
溶液中,![]()
B.稀释氨水溶液10倍后,其![]() 为原來的
为原來的![]()
C.pH之和为14的![]() 与NaOH溶液混合:
与NaOH溶液混合:![]()
D.将等物质的量的![]() 和
和![]() 混合溶于水中:
混合溶于水中:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
(1)实验一:取等物质的量浓度等体积H2O2溶液分别进行下列实验,实验报告如下表所示。
序号 | 条件 | 现象 | 结论 | |
温度/℃ | 催化剂 | |||
1 | 40 | FeCl3溶液 | ||
2 | 20 | FeCl3溶液 | ||
3 | 20 | MnO2 | ||
4 | 20 | 无 | ||
试回答:
①实验1、2研究的是_______________对H2O2分解速率的影响。
②实验2、3的目的是_____________________________________________________。
(2)实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在酸性高锰酸钾溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显但不久突然褪色,反应速率明显加快。
①针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是_____________________的影响。
②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是___________。
A、硫酸钾B、硫酸锰C、水D、氯化锰
(3)实验三:经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:
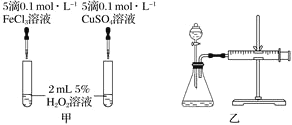
①定性如图甲可通过观察________________________________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是______________________________。
②定量如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。实验中需要测量的数据是_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生反应3A(g)+B(g)xC(g)+2D(g),经5s后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,v(C)为0.1mol/(L·s)
求:(1)x的值;___________
(2)以B表示的该反应的平均反应速率;___________
(3)此时A的浓度及反应开始前放入容器中的A、B的物质的量。___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列对该化合物的说法中,正确的是( )

A. 名称是乙醚
B. 只含有一种官能团
C. 链状同分异构体中,属于羧酸的有3种
D. 既能发生加聚反应,又能发生缩聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下X、Y、Z、W、R五种元素均为短周期元素,它们的化合价与原子序数的关系如图,下列说法正确

A.简单离子的半径: Y>Z>X
B.最高价氧化物对应水化物的酸性: R>W
C.单质的还原性: Z>Y
D.简单氢化物的沸点: W>X
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com