
【题目】将2mol X和2mol Y充入2L密闭容器中进行反应:X(g)+3Y(g)![]() 2Z(g)+aQ(g)。2min末该反应达到平衡时生成0.8mol Z,测得Q的浓度为0.4
2Z(g)+aQ(g)。2min末该反应达到平衡时生成0.8mol Z,测得Q的浓度为0.4![]() ,则
,则
(1)a的值为______
(2)平衡时X的浓度为_______
(3)平衡时Y的转化率_________
(4)0~2min内Y的反应速率为_______
(5)化学反应平衡时气体X的物质的量分数为_______
【答案】2 0.8mol/L 60% 0.3mol/(Lmin) 40%
【解析】
(1)根据n=cV计算生成的Q的物质的量,再根据转化物质的量之比等于化学计量数之比计算a的值;
(2)根据生成的n(Z),利用转化物质的量之比等于化学计量数之比计算参加反应的X的物质的量,进而计算平衡时X的物质的量,再根据c=n÷V计算;
(3)根据生成的n(Z),利用转化物质的量之比等于化学计量数之比计算参加反应的Y的物质的量,再根据转化率定义计算;
(4)根据υ=Δc÷Δt计算υ(Y);
(5)根据平衡时X的物质的量和总物质的量计算X的物质的量分数。
(1)平衡时生成0.8molZ,测得Q的浓度为0.4molL-1,则生成的n(Q)=0.4molL-1×2L=0.8mol,所以2:a=0.8mol:0.8mol,解得a=2;
(2)平衡时生成0.8molZ,则参加反应的X的物质的量为0.8mol×1/2=0.4mol,故平衡时X的物质的量为2mol-0.4mol=1.6mol,平衡时X的浓度为1.6mol÷2L=0.8mol/L;
(3)平衡时生成0.8molZ,则参加反应的Y的物质的量为0.8mol×3/2=1.2mol,故Y的转化率为1.2mol÷2mol×100%=60%;
(4)消耗Y的浓度是1.2mol÷2L=0.6mol/L,则反应速率υ(Y)=0.6mol/L÷2min=0.3mol/(Lmin);
(5)化学反应平衡时X、Y、Z、Q的物质的量分别是1.6mol、0.8mol、0.8mol、0.8mol,因此气体X的物质的量分数为1.6mol÷4mol×100%=40%。


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
【题目】下列关于甲烷的说法正确的是( )
A. 甲烷是含碳元素质量分数最高的有机物
B. 1 mol甲烷与1 molCl2反应恰好生成1mol一氯甲烷
C. CH2Cl2有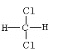 和
和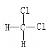 两种同分异构体
两种同分异构体
D. 有机物中的碳原子之间能以共价键结合,形成多种链状和环状
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂利用甲烷与氯气反应得到的副产品来制取盐酸实现了变废为宝的梦想,其生产原理可在实验室中模拟如下,请根据要求填空:

(1)写出装置A中发生反应的化学方程式_____;
(2)B装置的三种功能是①干燥混合气体,②使气体混合均匀,③_____;
(3)设![]() =x,若理论上欲获得最多的氯化氢,则x值应___;
=x,若理论上欲获得最多的氯化氢,则x值应___;
(4)在C装置中,经过一段时间的强光照射后,发现硬质玻璃管内壁附着有油珠,写出生成产物中密度最大的物质的化学方程式___;
(5)D装置的作用是___(填编号);
A.收集气体 B.吸收氯气 C.防止倒吸 D.吸收氯化氢
(6)该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为_____(填编号)。
①CH4 ②CH3Cl ③CH2Cl2 ④CHCl3 ⑤CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出与下列事实相符的金属钠的主要物理性质:
(1)用小刀切割金属钠,表现其______________________
(2)金属钠能浮在水面上,表现其______________________
(3)金属钠微微受热时会熔化成一个闪亮的小球,表现其___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一支硬质大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气,并置于光亮处(如图),下列对于试管内发生的反应及现象的说法正确的是( )
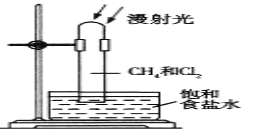
A. 反应过程中试管内黄绿色逐渐变浅,试管壁上有油珠产生
B. 将该装置放在黑暗处,![]() 与
与![]() 也能反应
也能反应
C. 该反应仅得到一种有机产物
D. ![]() 和
和![]() 完全反应后液面上升,液体充满试管
完全反应后液面上升,液体充满试管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3X(g)+Y(g) ![]() 2Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.5mol,则此反应的速率v为
2Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.5mol,则此反应的速率v为
A. v (X)=0.05mol·L-1·min-1B. v (Z)= 0.10mol·L-1·min-1
C. v (Y)=0.10mol·L-1·min-1D. v (W)=0.05mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列日常生活中涉及到一些化学知识分析正确的是
A.铝在空气中耐腐蚀,所以铝是不活泼金属
B.大力开发化石能源以推动经济发展
C.积极推广共享单车以减少雾霾和光化学烟雾
D.焰火的五彩缤纷是某些金属元素化学性质的呈现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,改变饱和氯水的pH,得到部分含氯微粒的物质的量分数与pH的关系如图所示。下列叙述不正确的是
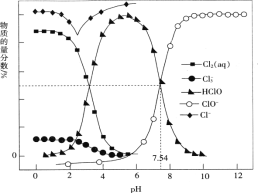
A. 氯水中的Cl2、ClO-、HClO均能与KI发生反应
B. 常温下反应Cl2(aq)+Cl-(aq)![]()
![]() (aq)的K=0.191,当pH增大时,K减小
(aq)的K=0.191,当pH增大时,K减小
C. pH=1的氯水中,c(Cl2)>c(![]() )>c(HClO)>c(ClO-)
)>c(HClO)>c(ClO-)
D. 该温度下,HClO![]() H++ClO-的电离常数Ka的对值lgKa=-7.54
H++ClO-的电离常数Ka的对值lgKa=-7.54
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室制取乙酸乙酯的主要步骤如下:
①在甲试管(如图)中加入2mL浓硫酸、3mL乙醇和2mL乙酸的混合溶液。
②按如图连接好装置(装置气密性良好)并加入混合液,小火均匀地加热3—5min。
③待试管乙收集到一定量产物后停止加热,撤出试管并用力振荡,然后静置待分层。
④分离出乙酸乙酯层、洗涤、干燥。
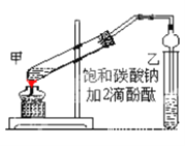
(1)若实验中用乙酸和含18O的乙醇作用,该反应的化学方程式是:________________________;与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是________________________。
(2)甲试管中,混合溶液的加入顺序:________________________;
(3)步骤②中需要用小火均匀加热,其主要原因是____________________________________;
(4)上述实验中饱和碳酸钠溶液的作用是____________(填字母代号)。
A. 反应掉乙酸和乙醇
B. 反应掉乙酸并吸收乙醇
C. 乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D. 加速酯的生成,提高其产率
(5)欲将乙试管中的物质分离开以得到乙酸乙酯,必须使用的仪器是____________;分离时,乙酸乙酯应该从仪器____________(填:“下口放”或“上口倒”)出。
(6)生成乙酸乙酯的反应是可逆反应,反应一段时间后,下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有____________(填序号)。
①混合物中各物质的浓度不再变化;
②单位时间里,生成1mol乙醇,同时生成1mol乙酸;
③单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸。
(7)为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图所示装置进行了以下4个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管Ⅱ再测有机层的厚度,实验记录如下:
实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 有机层的 厚度/cm |
A | 2mL乙醇、1mL乙酸、3mL 18mol·L1浓硫酸 | 饱和Na2CO3溶液 | 3. 0 |
B | 2mL乙醇、1mL乙酸、3mL H2O | 0. 1 | |
C | 2mL乙醇、1mL乙酸、3mL 2mol·L1 H2SO4 | 0. 6 | |
D | 2mL乙醇、1mL乙酸、盐酸 | 0. 6 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是_________mL和________mol·L1。
②分析实验_________(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率。
(8)若现有乙酸90g,乙醇138g发生酯化反应得到88g乙酸乙酯,试计算该反应的产品产率为。___________(产率%=(实际产量/理论产量)×100%)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com