
【题目】用如图装置制取并收集气体,对应的装置和试剂均正确的是( )
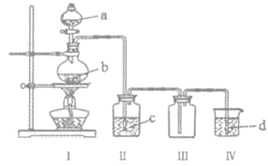
Ⅲ收集气体 | Ⅰ中试剂a,b | Ⅱ中试剂c | Ⅳ中试剂d | |
A | SO2 | 稀硫酸与铜片 | 浓硫酸 | NaOH溶液 |
B | Cl2 | 浓盐酸与二氧化锰 | 饱和氯化钠溶液 | NaOH 溶液 |
C | HBr | 浓硫酸与溴化钠 | 浓硫酸 | 水 |
D | CO | 甲酸与浓硫酸 | 浓硫酸 | 酸性KMnO4溶液 |
A. AB. BC. CD. D
科目:高中化学 来源: 题型:
【题目】用如图装置制取并收集气体,对应的装置和试剂均正确的是( )

Ⅲ收集气体 | Ⅰ中试剂a,b | Ⅱ中试剂c | Ⅳ中试剂d | |
A | SO2 | 稀硫酸与铜片 | 浓硫酸 | NaOH溶液 |
B | Cl2 | 浓盐酸与二氧化锰 | 饱和氯化钠溶液 | NaOH 溶液 |
C | HBr | 浓硫酸与溴化钠 | 浓硫酸 | 水 |
D | CO | 甲酸与浓硫酸 | 浓硫酸 | 酸性KMnO4溶液 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废水中氨氮(NH3、NH![]() )的处理技术有生物脱氮法、化学沉淀法、折点加氯法和电催化氧化法等。
)的处理技术有生物脱氮法、化学沉淀法、折点加氯法和电催化氧化法等。
(1) 氨氮污水直接排放入河流、湖泊导致的环境问题是________。
(2) 生物脱氮法:利用微生物脱氮,原理如下:
NH![]()
![]() NO
NO![]()
![]() N2
N2
反应①的离子方程式为__________________________________。
(3) 化学沉淀法:向废水中加入含MgCl2、Na3PO4的溶液,NH![]() 转化为MgNH4PO4·6H2O沉淀。若pH过大,氨氮去除率和磷利用率均降低,其原因是________(用离子方程式表示)。
转化为MgNH4PO4·6H2O沉淀。若pH过大,氨氮去除率和磷利用率均降低,其原因是________(用离子方程式表示)。
(4) 折点加氯法:向废水中加入NaClO溶液,使氨氮氧化成N2,相关反应如下:
NaClO+H2O===HClO+NaOH(Ⅰ)
NH3+HClO===NH2Cl+H2O(Ⅱ)
NH2Cl+HClO===NHCl2+H2O(Ⅲ)
NHCl2+H2O===NOH+2HCl(Ⅳ)
NHCl2+NOH===N2↑+HClO+HCl(Ⅴ)
探究NaClO的投加量[以m(Cl2)表示]对氨氮去除率的影响,实验结果如图所示。
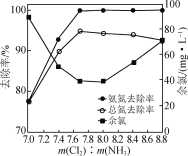
①当m(Cl2)∶m(NH3)≥7.7时,污水中总氮去除率缓慢下降,其原因是__________________。
②当m(Cl2)∶m(NH3)<7.7时,随着m(Cl2)∶m(NH3)的减小,污水中余氯(除Cl-外的氯元素存在形式)浓度升高,其原因是____________________________。
(5) 电催化氧化法:原理如下图所示(MOx表示催化剂)。反应Ⅱ的离子方程式可表示为2NH4++6MOx(·OH)===6MOx+N2↑+6H2O+2H+。
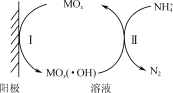
①阳极电极反应式Ⅰ为________________________________。
②电催化氧化法除氨氮时,若其他条件相同时,含Cl-的污水比不含Cl-的污水氨氮去除率要高,其原因是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设为阿伏加德罗常数的值。下列说法正确的是
A.1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1![]()
B.标准状况下,1L戊烷充分燃烧后生成的气态产物的分子数为5/22.4![]()
C.pH=13的NaOH溶液中含有的OH-为0.1mol
D.在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,向![]() 和过量C粉的混合物中通入氯气,可制得易水解的
和过量C粉的混合物中通入氯气,可制得易水解的![]() ,实验装置如图所示。下列说法不正确的是
,实验装置如图所示。下列说法不正确的是 ![]()
![]()
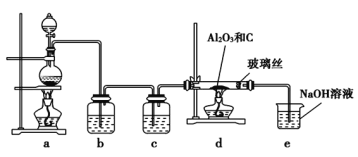
A.c中盛装的是浓硫酸
B.实验结束时,应先熄灭d处酒精灯,待装置冷却后再熄灭a处酒精灯
C.此反应中的尾气除氯气外都可直接排放到大气中
D.该装置不完善,其中应改进的一项是在d、e之间添加一个干燥装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室制备氯气并进行一系列相关实验的装置(夹持装置已略)。
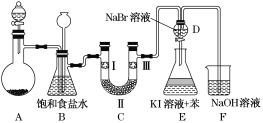
(1)制备氯气选用的试剂为漂粉精固体和浓盐酸,则相关反应的化学方程式为________________。
(2)装置B中饱和食盐水的作用是__________________________________;
同时装置B也是安全瓶,监测实验进行时装置C是否发生堵塞,请写出发生堵塞时装置B中的现象: __________________________________________。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此装置C中Ⅰ、Ⅱ、Ⅲ处依次放入________(填字母)。
a | b | c | d | |
Ⅰ | 干燥的 有色布条 | 干燥的 有色布条 | 湿润的 有色布条 | 湿润的 有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的 有色布条 | 湿润的 有色布条 | 干燥的 有色布条 | 干燥的 有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D装置中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为______色,说明氯的非金属性强于溴。
(5)打开活塞,将装置D中少量溶液加入装置E中,振荡后静置。观察到的现象是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以黄铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
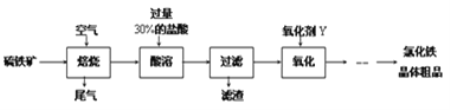
请按要求回答下列问题:
(1)需将硫铁矿粉碎再焙烧的目的是______________________________________.
(2)酸溶及后续过程中均需保持盐酸过量,其目的是_____________、__________.
(3)尾气主要含N2、O2、SO2和少量的CO2、H2O(g).测定尾气中SO2含量的方案如下:
(方案甲)将标准状况下的2.24 L尾气缓慢通过如下装置A中:
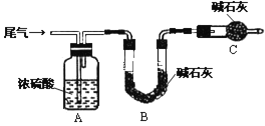
①C仪器的名称是_______________,装置C的作用是_________________________.
②实验时先通入尾气,再通入一定量氮气,通过B装置的增重来测量SO2的体积分数,请写出该方案合理与否的理由__________________________________________.
(方案乙)将标准状况下的2.24 L尾气缓慢通过如下装置D中,充分与足量试剂M反应后,再滴入过量试剂N,经过滤、洗涤、干燥、用电子天平称得沉淀质量为0.233g.
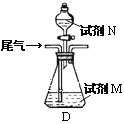
③若试剂M、N分别是碘水、BaCl2溶液,写出D中总反应的离子方程式: __________________.尾气中SO2的体积分数为__________________.
④若试剂M是Ba(NO3)2溶液,不再滴加试剂N,观察到D中生成的无色气体在瓶口处变为红棕色.写出SO2和Ba(NO3)2溶液反应的离子方程式:___________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一真空密闭容器中盛有1molPCl5,加热到200 ℃,发生反应:PCl5(g)![]() PCl3(g)+Cl2(g),反应达到平衡时,PCl5在混合气体中的体积分数为m%,若在相同的温度和相同的容器中,起始时加入2molPCl5,反应达到平衡时,PCl5在混合气体中的体积分数为n%,则m和n的关系正确的是( )
PCl3(g)+Cl2(g),反应达到平衡时,PCl5在混合气体中的体积分数为m%,若在相同的温度和相同的容器中,起始时加入2molPCl5,反应达到平衡时,PCl5在混合气体中的体积分数为n%,则m和n的关系正确的是( )
A.2m=nB.m=nC.m>nD.m<n
查看答案和解析>>
科目:高中化学 来源: 题型:
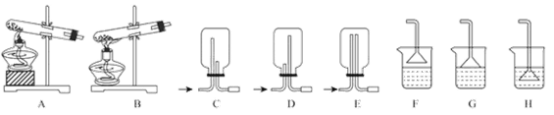
【题目】NH3及其盐都是重要的化工原料。
(1)用NH4Cl和Ca(OH)2制备NH3,反应发生、气体收集和尾气处理装置依次为_____。
(2)按下图装置进行NH3性质实验。
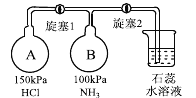
①先打开旋塞1,B瓶中的现象是_______,原因是__________,稳定后,关闭旋塞1。
②再打开旋塞2,B瓶中的现象是_________________。
(3)设计实验,探究某一种因素对溶液中NH4Cl水解程度的影响。
限制试剂与仪器:固体NH4Cl、蒸馏水、100mL容量瓶、烧杯、胶头滴管、玻璃棒、药匙、天平、pH计、温度计、恒温水浴槽(可控制温度)
①实验目的:探究______对溶液中NH4Cl水解程度的影响。
②设计实验方案,拟定实验表格,完整体现实验方案(列出能直接读取数据的相关物理量及需拟定的数据,数据用字母表示;表中V(溶液)表示所配制溶液的体积)。_________________
物理量 | V(溶液)/mL | …… | |||
1 | 100 | ||||
2 | 100 |
③按实验序号I所拟数据进行实验,若读取的待测物理量的数值为Y,则NH4Cl水解反应得平衡转化率
为_____(只列出算式,忽略水自身电离的影响)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com