
【题目】一定条件下,密闭容器中的H2在催化剂的催化下可高效转化酸性溶液中的硝态氮(![]() )以达到消除污染的目的。其工作原理的示意图如图:
)以达到消除污染的目的。其工作原理的示意图如图:
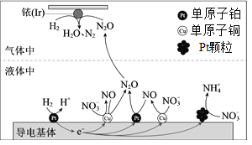
下列说法正确的是
A.导电基体上的正极产物仅有NO和![]()
B.若导电基体上的Pt颗粒增多,不利于降低溶液中的含氮量
C.若导电基体上只有单原子铜,![]() 能全部转化为N2O
能全部转化为N2O
D.若Ir的表面处理1molN2O,理论上负极消耗89.6LH2
【答案】B
【解析】
由示意图可知,导电基体上H2在单原子铂表面转化为H+,发生氧化反应,为负极,![]() 部分在铂颗粒表面转化为
部分在铂颗粒表面转化为![]() ,部分在单原子铜表面转化为NO,NO又在单原子铂表面转化为N2O,发生还原反应,为正极;Ir的表面氢气和N2O发生反应生成N2和H2O,结合氧化还原反应的规律分析解答。
,部分在单原子铜表面转化为NO,NO又在单原子铂表面转化为N2O,发生还原反应,为正极;Ir的表面氢气和N2O发生反应生成N2和H2O,结合氧化还原反应的规律分析解答。
A.由示意图可知,导电基体上H2在单原子铂表面转化为H+,为负极,![]() 部分在铂颗粒表面转化为
部分在铂颗粒表面转化为![]() ,部分在单原子铜表面转化为NO,NO又在单原子铂表面转化为N2O,为正极,因此正极产物有NO、N2O和
,部分在单原子铜表面转化为NO,NO又在单原子铂表面转化为N2O,为正极,因此正极产物有NO、N2O和![]() ,故A错误;
,故A错误;
B.由示意图可知,导电基体上![]() 部分在铂颗粒表面转化为
部分在铂颗粒表面转化为![]() ,若导电基体上的Pt颗粒增多,则
,若导电基体上的Pt颗粒增多,则![]() 会更多的转化成铵根,将不利于降低溶液中的含氮量,故B正确;
会更多的转化成铵根,将不利于降低溶液中的含氮量,故B正确;
C.由示意图可知,导电基体上![]() 在单原子铜表面转化为NO,NO又在单原子铂和铜表面转化为N2O,若导电基体上只有单原子铜,
在单原子铜表面转化为NO,NO又在单原子铂和铜表面转化为N2O,若导电基体上只有单原子铜,![]() 将不能全部转化为N2O,故C错误;
将不能全部转化为N2O,故C错误;
D.由原理的示意图可知,Ir的表面氢气和N2O发生反应生成N2和H2O,若Ir的表面处理1molN2O,转移2mol电子,理论上负极消耗1mol氢气,未告知温度和压强,无法计算氢气的体积,故D错误;
故选B。


科目:高中化学 来源: 题型:
【题目】某空间站中宇航员的呼吸保障系统原理如图所示。
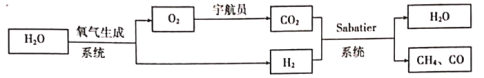
Sabatier系统中发生反应为:
反应I:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)△H1
CH4(g)+2H2O(g)△H1
反应II:CO2(g)+H2(g)![]() CO(g)+H2O(g)△H2=+41.2kJ/mol
CO(g)+H2O(g)△H2=+41.2kJ/mol
(1)常温常压下,已知:
①H2和CH4的燃烧热(△H)分别为-285.5kJ·mol-1和-890.0kJ·mol-1;
②H2O(l)=H2O(g)△H3=+44.0kJ·mol-1。则△H1=__________kJ·mol-1。
(2)按![]() =4的混合气体充入Sabatier系统,当气体总压强为0.1MPa,平衡时各物质的物质的量分数如图所示;不同压强时,CO2的平衡转化率如图所示:
=4的混合气体充入Sabatier系统,当气体总压强为0.1MPa,平衡时各物质的物质的量分数如图所示;不同压强时,CO2的平衡转化率如图所示:
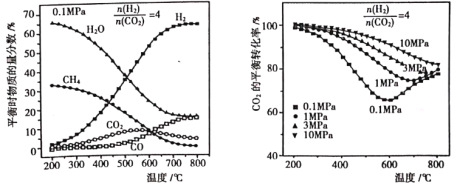
①Sabatier系统中应选择适宜的温度是__________。
②200~550℃时,CO2的物质的量分数随温度升高而增大的原因是__________。
③当温度一定时,随压强升高,CO2的平衡转化率增大,其原因是__________。
(3)一种新的循环利用方案是用Bosch反应[CO2(g)+2H2(g)![]() C(s)+2H2O(g)]代替Sabatier系统。
C(s)+2H2O(g)]代替Sabatier系统。
①分析Bosch反应的熵值变化为:△S__________0(选填“>”或“<”)。
②温度一定时,在2L密闭容器中按![]() =2投料进行Bosch反应,达到平衡时体系的压强为原来压强p0的0.7倍,该温度下反应平衡常数Kp为__________(用含p0的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
=2投料进行Bosch反应,达到平衡时体系的压强为原来压强p0的0.7倍,该温度下反应平衡常数Kp为__________(用含p0的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③下列措施能提高Bosch反应中CO2转化率的是_________(填标号)。
A.加快反应器中气体的流速B.提高原料气中CO2所占比例
C.增大催化剂的表面积D.反应器前段加热,后段冷却
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中的颜色变化,与氧化还原反应无关的是( )
选项 | 实验操作 | 现象 |
A | AgNO3溶液滴入氯水中 | 产生白色沉淀,随后淡黄绿色逐渐褪去 |
B | FeCl3溶液滴入Mg(OH)2浊液中 | 白色浑浊转化为红褐色沉淀 |
C | H2C2O4溶液滴入KMnO4酸性溶液中 | 产生气泡,随后紫色褪去 |
D | Na块放在坩埚里并加热 | 发出黄色火焰,生成淡黄色固体 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。

(实验一)碘含量的测定。取0.0100mol/L的AgNO3标准溶液装入滴定管,取100.00mL海带浸取原液至滴定池,用电势滴定法测定碘含量。测得的电动势(E)反映溶液中c(I-)的变化,部分数据如下表:
V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
回答下列问题:
(1)实验中“灼烧”是在__(填仪器名称)中完成的。
(2)用文字具体描述“定容”过程:__
(3)根据表中数据判断滴定终点时用去AgNO3溶液的体积为__mL,计算得海带中碘的质量百分含量为__%。
(实验二)碘的制取。另制海带浸取原液,甲、乙两种实验方案如下:

已知:3I2+6NaOH=5NaI+NaIO3+3H2O。
(4)“适量O2”中能代替O2的最佳物质对应的电子式为__
(5)若要测定“I2+水溶液”中碘的含量,可以选择__作指示剂,用Na2S2O3溶液滴定,滴定终点的现象是__。
(6)若得到“I2+水溶液”时加入硫酸溶液过多,用Na2S2O3溶液滴定时会产生明显的误差,产生此误差的原因为__(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A.标准状况下,2.24LHF中含有的极性键数目为0.1NA
B.18g重氢氨基(-ND2)中含有的电子数为10NA
C.33.6L氯气与足量铝充分反应,转移电子数为3NA
D.7g乙烯和丙烯混合气体中的氢原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B两种常见金属元素的相对原子质量之比是8∶9。将两种金属单质按物质的量之比为3∶2组成1.26g混合物。将此混合物与足量稀硫酸反应,放出1.344L(标准状况)氢气。若这两种金属单质在反应中生成氢气的物质的量相等,求A、B两金属的摩尔质量各为多少___?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分元素的原子结构特点如表,下列叙述中正确的是( )
X | L层电子数是K层电子数的3倍 |
Y | 核外电子层数等于原子序数 |
Z | L层电子数是K层和M层电子数之和 |
W | 共用三对电子形成双原子分子,常温下为气体单质 |
A.W原子结构示意图为![]()
B.元素X和Y只能形成原子个数比为1∶2的化合物
C.元素X比元素Z的非金属性强
D.X、Y、Z、W四种元素不能形成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为_____、_____(填标号)。
A.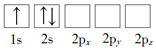 B.
B.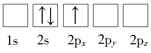
C.![]() D.
D.![]()
(2)Li+与H具有相同的电子构型,r(Li+)小于r(H),原因是______。
(3)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是______、中心原子的杂化形式为______。LiAlH4中,存在_____(填标号)。
A.离子键 B.σ键 C.π键 D.氢键
(4)Li2O是离子晶体,其晶格能可通过图(a)的BornHaber循环计算得到。
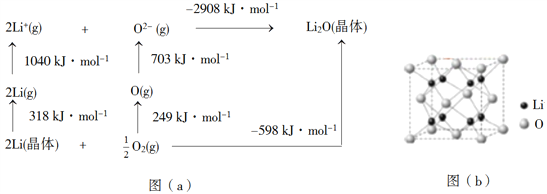
可知,Li原子的第一电离能为________kJ·mol1,O=O键键能为______kJ·mol1,Li2O晶格能为______kJ·mol1。
(5)Li2O具有反萤石结构,晶胞如图(b)所示。已知晶胞参数为0.4665 nm,阿伏加德罗常数的值为NA,则Li2O的密度为______g·cm3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.32![]() 中含有的氧原子数是2×6.02×1023
中含有的氧原子数是2×6.02×1023
B.N2和CO共1mol的混合气体中含有的分子总数是2×6.02×1023
C.2.3 g Na与O2完全反应生成3.6 g产物时失电子数是0.1×6.02×1023
D.1.0 L 0.1 mol·L-1NH4NO3溶液中含有的铵根离子数是0.1×6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com