
【题目】一定条件下,20.00mL0.2mol·L-1的Na2Cr2O7溶液与30.00mL0.1mol·L-1的Na2S2O3恰好反应完全,生成了Cr3+和一种含硫物质,该含硫物质中硫元素的化合价是( )
A.-2B.0C.+4D.+6
科目:高中化学 来源: 题型:
【题目】某模拟“人工树叶”电化学实验装置如下图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是
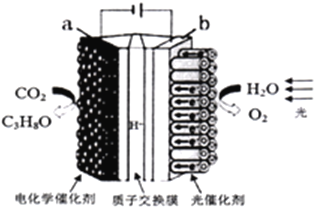
A. 该装置将化学能转化为光能和电能
B. a电极的反应为:3CO2+16H+-18e-=C3H8O+4H2O
C. 该装置工作时,H+从b极区向a极区迁移
D. 每生成1molO2有44gCO2被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。
N2+3H2![]() 2NH3
2NH3
现向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使该反应发生,下列有关说法正确的是( )
A.达到化学平衡时,N2将完全转化为NH3
B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
D.达到化学平衡时,正反应和逆反应的速率都为零
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作和现象正确的是
操作 | 结论 | 现象 | |
A | 向 | 有气泡生成 | 非金属性Cl>S |
B | 溶有 | 有白色沉淀生成 | X一定是 |
C | 向稀硫酸酸化的 | 溶液变黄色 | 氧化性 |
D | 向稀硫酸中加入铜片,然后通入 | 先无明显现象,通入加热后变蓝 | 氧化性:稀硫酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnSO4是制备高纯MnCO3的中间原料。实验室用如图所示装置可制备少量MnSO4溶液,反应原理为:MnO2+H2SO3=MnSO4+H2O;下列说法错误的是( )
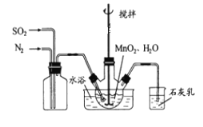
A. 缓慢通入混合气体可提高SO2的转化率
B. 若不通N2,则烧瓶中的进气管口容易被堵塞
C. 若实验中将N2换成空气,则反应液中c(Mn2+)/c(SO42-)的浓度之比变大
D. 石灰乳对尾气的吸收效果比澄清石灰水更好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们发现金星大气层有一种称之为羰基硫(COS)的分子,其结构与CO2类似,羰基硫是一种与生命密切相关的物质,下列推测不正确的是( )
A. COS是含有极性键的共价化合物B. COS的沸点比CO2高
C. COS 电子式为![]() D. COS中所有原子满足8电子稳定结构
D. COS中所有原子满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 无色透明溶液中: Zn2+、SO42-、NH4+,Cl-
B. 0.1mol/L NaHCO3溶液中: Mg2+、Al3+、K+、NO3-
C. 能使甲基橙变黄的溶液中: Na+,CH3COO-、 MnO4-、 Fe3+
D. c(H+)/c(OH-)=1×1012的溶液中:NO3-、I-、K+、Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气与碱溶液反应,在低温、稀碱溶液中主要产物是ClO-和Cl-,在75℃以上、浓碱溶液中主要产物是ClO3-和Cl-。研究小组用如下实验装置制取氯酸钾(KClO3),并测定其纯度。

a为浓盐酸,b为MnO2,c为饱和食盐水,d为30%KOH溶液,e为NaOH溶液
回答下列问题:
(1)检查装置气密性后,添加药品,待装置III水温升至75℃开始反应。
①装置I中反应的离子方程式为_______________。
②若取消装置II,对本实验的影响是_______________。
③实验结束,拆解装置I前为了防止大量氯气逸出,可采取的措施是_______________。
④从装置III的试管中分离得到KClO3粗产品,其中混有的杂质是KClO和______________。
(2)为测定产品KClO3的纯度,进行如下实验:
步骤1:取2.45g样品溶于水配成250mL溶液。
步骤2:取25.00mL溶液于锥形瓶中,调至pH=10,滴加足量H2O2溶液充分振荡以除尽ClO-。然后煮沸溶液1~2分钟,冷却。
步骤3:加入过量KI溶液,再逐滴加入足量稀硫酸。(ClO3-+6I-+6H+=Cl-+3I2+3H2O)
步骤4:加入指示剂,用0.5000mol/LNa2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。 (2S2O32-+I2=S4O62-+2I-)
①步骤2中除去C1O-的离子方程式是_____________。“煮沸”的目的是_________。
②比较碱性条件下氧化性ClO3-_______C1O-(填写“>”或“<”)。
③样品中KClO3的貭量分数为________。(答案保留三位有效数字,KClO3式量:122.5)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com