
【题目】现有一定量含有Na2O杂质的Na2O2试样,用下图所示的实验装置测定Na2O2试样的纯度。(可供选用的试剂只有CaCO3固体、6 mol·L-1盐酸、6 mol·L-1硫酸和蒸馏水)回答下列问题:
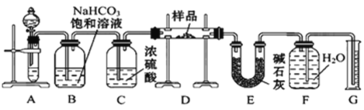
(1)装置B的作用是___________________; 装置E中碱石灰的作用是_________________________________。
(2)装置D中发生反应的化学方程式是_________________;______________________.
(3)超氧化钾(KO2)与过氧化钠一样能吸收CO2生成碳酸盐及O2,写出该反应的化学方程式_________________________。
(4)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为___________。
【答案】除去气体中的HCl 吸收装置D中反应剩余的CO2 2Na2O2+2CO2=2Na2CO3+O2 Na2O+CO2 =Na2CO3 4KO2 +2CO2=2K2CO3+3O2 78%
【解析】
(1)获得的二氧化碳气体中含有氯化氢气体,可以用饱和碳酸氢钠来除去,浓硫酸具有吸水性,碱石灰可以吸收二氧化碳;
(2)根据氧化钠和过氧化钠的性质来回答;
(3)根据信息写出化学方程式;
(4)根据氧气的量和过氧化钠量的关系来获得过氧化钠质量,进而计算过氧化钠的纯度.
(1)碳酸钙和盐酸反应生成的二氧化碳气体中含有氯化氢气体,可以用饱和碳酸氢钠来除去,浓硫酸具有吸水性,可以将二氧化碳干燥,装置E中碱石灰的作用是吸收二氧化碳,防止对氧气的体积测量造成干扰,
故答案为:除去气体中的HCl;吸收装置D中反应剩余的二氧化碳;
(2)氧化钠和过氧化钠和二氧化碳反应的原理方程式分别为:2Na2O2+2CO2=2Na2CO3+O2 ; Na2O+CO2 =Na2CO3 ,
故答案为:2Na2O2+2CO2=2Na2CO3+O2 ; Na2O+CO2 =Na2CO3 ;
(3)超氧化钾(KO2)与过氧化钠一样能吸收CO2生成碳酸盐及O2,依据元素守恒可知碳酸盐应该是碳酸钾,反应的化学方程式是:4KO2 +2CO2=2K2CO3+3O2 ,
故答案为:4KO2 +2CO2=2K2CO3+3O2;
(4)根据反应2Na2O2+2CO2=2Na2CO3+O2 反应结束后测得气体体积为224mL(标准状况),即生成的氧气的量0.01mol,过氧化钠的物质的量为0.02mol,
过氧化钠的纯度=0.02mol×78g/mo÷l2.0g×100%=78%,
故答案为:78%.


科目:高中化学 来源: 题型:
【题目】科学家合成出了一种用于分离镧系金属的化合物 A(如下图所示),短周期元素 X、Y、Z原子序数依次增大,其 中 Z位于第三周期。Z与 Y2可以形成分子 ZY6,该分子常用作高压电气设备的绝缘介质。下列关于 X、Y、Z的叙述,正确的是
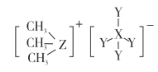
A.离子半径:Y >Z
B.氢化物的稳定性:X >Y
C.最高价氧化物对应水化物的酸性:X >Z
D.化合物 A中,X、Y、Z最外层都达到 8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据已经学过的化学知识,回答下列问题。
I.金属及其化合物在生产生活中有着广泛的应用,
(1)胃舒平(主要成分为氢氧化铝)可用于治疗胃酸过多,氢氧化铝体现_______性;_______(填“能”或“不能”)用氢氧化钠溶液代替。
(2)将Cu与稀硫酸混合,二者不能反应,滴入H2O2后,溶液很快变成蓝色,该反应的化学方程式为____________________________________________。
(3)NaHSO4是一种酸式盐,写出NaHSO4在水中的电离方程式_________________________。
II.物质的量是学习化学的基础。
(1)14.4 g CO和CO2的混合气体在标准状况下所占的体积为8.96 L,其中CO的质量为_____。
(2)市售浓H2SO4的质量分数为98%、密度为1.84g/cm3,其浓度为________mol·L-1。
(3)19g某二价金属的氯化物ACl2中含有0.4mo1Cl-离子,金属A的相对原子质量是_______。
(4)根据反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,可知当有2.5 mol FeS2参加反应时,被氧化的硫的物质的量为_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是
A.常温下lLpH=7的lmol/LCH3COONH4溶液中CH3COO-与![]() 数目均为NA
数目均为NA
B.162g聚合度为n的纤维素,含有羟基的数目为3nNA个
C.标准状态下,22.4LCl2完全溶于水后,有Cl2、HClO、ClO-的总数目为NA
D.标准状态下,lL苯完全燃烧生成的气态产物的分子数为![]() NA
NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25°C时,向10mL0.10mol·L-1的一元弱酸HA(Ka =1.0×10-3)中逐滴加入0.10mol·L-1NaOH溶液,溶液pH随加入NaOH溶液体积的变化关系如图所示。下列说法正确的是( )
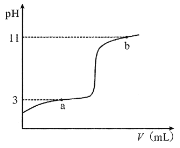
A.a点时,c(HA)+c(OH-)=c(Na+)+c(H+)
B.溶液在a点和b点时水的电离程度相同
C.b点时,c(Na+)=c(HA)+c(A- )+c(OH-)
D.V =10mL时,c(Na+)>c(A-)>c(H+)>c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖花落锂离子电池,美英日三名科学家获奖,他们创造了一个可充电的世界。像高能LiFePO4电池,多应用于公共交通。电池中间是聚合物的隔膜,主要作用是在反应过程中只让Li+通过。结构如图所示。
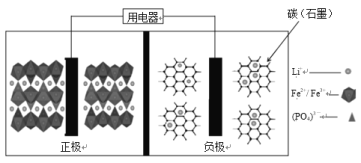
原理如下:(1 x)LiFePO4+xFePO4+LixCn![]() LiFePO4+nC,下列说法不正确的是
LiFePO4+nC,下列说法不正确的是
A.放电时,正极电极反应式:xFePO4+xLi++xe=xLiFePO4
B.放电时,电子由负极经导线、用电器、导线到正极
C.充电时,阴极电极反应式:xLi++nC=LixCn-xe
D.充电时,Li+向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“结晶玫瑰”具有强烈的玫瑰香气,属于结晶型固体香料,在香料和日用化工产品中具有广阔的应用价值。“结晶玫瑰”的化学名称为乙酸三氯甲基苯甲酯,通常用三氯甲基苯基甲醇和醋酸酐为原料制备。
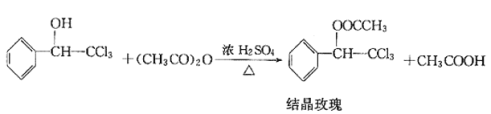
已知:
物质 | 在乙醇中的溶解性 | 在水中的溶解性 | 熔点℃ |
三氯甲基苯基甲醇 | 溶 | 不溶 | — |
醋酸酐 | 溶 | 溶 | -73 |
结晶玫瑰 | 溶 | 不溶 | 88 |
醋酸 | 易溶 | 易溶 | 16.6 |
部分实验装置以及操作步骤如下:
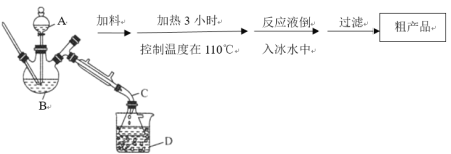
请根据以上信息,回答下列问题:
(1)装置中仪器B的名称是___________。
(2)加料时,应先加入三氯甲基苯基甲醇和醋酸酐,然后慢慢加入浓硫酸并搅拌。待混合均匀后,最适宜的加热方式为油浴加热,用油浴加热的理由是_______________。有同学认为装置中A仪器也可改为另一种漏斗,该漏斗的名称是___________,它的作用是____________。
现有同学设计如下方案把粗产品进行提纯。
(3)①将粗产品溶解在________(填“水”、“乙醇”或“粗产品滤液”)中均匀混合,用水浴加热到70℃,回流溶剂使粗产品充分溶解,得到无色溶液。然后将所得溶液经过__________(填操作方法)析出白色晶体,整个过程中不需要用到的仪器是_______(选择相应字母填空)。
A.冷凝管 B.烧杯 C.蒸发皿 D.玻璃棒
②将步骤①所得混合物过滤、洗涤、干燥得到白色晶体,请列举一种常见的实验室干燥的方法_______。可通过测定晶体的熔点判断所得晶体是否是结晶玫瑰,具体做法为:加热使其熔化测其熔点,实验现象为__________。
(4)ag的三氯甲基苯基甲醇与足量乙酸酐充分反应得到结晶玫瑰bg,则产率是_________。(用含a、b的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如图的实验装置:
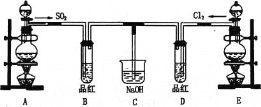
(1)实验室用装置A,用浓硫酸和铜反应制备SO2,请写出化学反应方程式____________
(2)反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:B_____、D______,停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B_____、D______。
(3)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com