
【题目】(1)利用CO、H2制造CH3OCH3有三个途径:
CO(g)+H2(g)═CH3OH(g) △H1=-91kJmol-1 平衡常数K1
2CH3OH(g)═CH3OCH3(g)+H2O △H2=-24kJmol-1 平衡常数K2
CO(g)+H2O(g)═CO2(g)+H2(g) △H3=-41kJmol-1 平衡常数K3
新工艺的总反应式为3CO(g)+3H2(g)═CH3OCH3(g)+CO2(g)则该反应的△H=_____,化学平衡常数为K=__(用K1、K2、K3的代数式表示);
(2)一定条件下气体A与气体B反应生成气体C,反应过程中反应物与生成物的浓度随时间变化的曲线如图.此反应在达到平衡时,A的转化率为__;

(3)研究减少有毒气体的排放对改善环境消除雾霾有十分重要的意义。利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s)5CO2(g)+I2(s) △H。不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4molCO,测得CO2的体积分数φ(CO2)随时间t变化曲线如图。

请回答:
①该反应属于__反应(填“放热”或“吸热“);
②从反应开始至a点时的反应速率为v(CO)=___,b点时化学平衡常数Kb=__;
③下列说法不正确的是____(填字母序号)。
a.容器内气体密度不变,表明反应达到平衡状态
b.两种温度下,c点时体系中混合气体的压强相等
c.增大d点的体系压强,CO的转化率不变
d.b点和d点的化学平衡常数:Kb<Kd
【答案】-247kJmol-1 K12K2K3 75% 放热 1.2molL-1min-1 1024 bd
【解析】
(1)结合三个方程式利用盖斯定律分析解答;
(2)根据转化了的浓度与起始浓度之比可求得A的转化率;
(3)①由图象可知:d点所在曲线反应速率快,温度高,但CO2的体积分数小,结合温度对平衡的影响分析判断;②根据起始量和a点时CO2的体积分数(即物质量分数),利用三段式计算从反应开始至a点时的反应速率为v(CO);根据b点时CO2的体积分数φ(CO2求出CO和CO2的平衡浓度进而求出b点时化学平衡常数Kb;③根据化学平衡的特征结合温度、压强对平衡的影响分析判断。
(1)①CO(g)+H2(g)═CH3OH(g)△H1=-91kJmol-1平衡常数K2;②2CH3OH(g)═CH3OCH3(g)+H2O△H2=-24kJmol-1平衡常数K2;③CO(g)+H2O(g)═CO2(g)+H2(g)△H3=-41kJmol-1平衡常数K3;
根据盖斯定律,反应①×2+②+③,可得到,3CO(g)+3H2(g)═CH3OCH3(g)+CO2(g)△H=(-91kJmol-1)×2+(-24kJmol-1)+(-41kJmol-1)=-247kJmol-1,则K=K12K2K3,故答案为:-247kJmol-1;K12K2K3;
(2)根据转化了的浓度与起始浓度之比可求得A的转化率为![]() ×100%=75%,故答案为:75%;
×100%=75%,故答案为:75%;
(3)①5CO(g)+I2O5(s)5CO2(g)+I2(s),由图象可知:ad曲线反应速率快,温度高,但CO2的体积分数小,即升高温度,平衡逆向移动,故该反应为放热反应,故答案为:放热;
②)①设反应5min内转化CO物质的量为xmol,a点时:
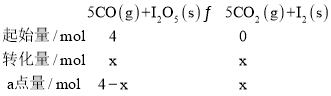
根据a点时CO2的体积分数φ(CO2)=![]() =0.30,得x=1.2,则从反应开始至a点时的反应速率为v(CO)=
=0.30,得x=1.2,则从反应开始至a点时的反应速率为v(CO)= ![]() =
=![]() =
=![]() =1.2molL-1min-1;
=1.2molL-1min-1;
设起始到平衡转化CO物质的量为ymol,b点时:
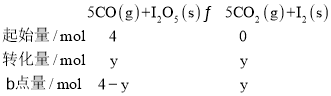
根据b点时CO2的体积分数φ(CO2)=![]() =0.80,得y=3.2,c(CO)=0.4molL-1,c(CO2)=1.6molL-1,b点时化学平衡常数Kb=
=0.80,得y=3.2,c(CO)=0.4molL-1,c(CO2)=1.6molL-1,b点时化学平衡常数Kb=![]() =
=![]() =1024,故答案为:1.2molL-1min-1;1024;
=1024,故答案为:1.2molL-1min-1;1024;
③a.因为条件为恒容,而反应前后气体质量发生变化,容器内气体密度为变量,所以容器内气体密度不变时,表明反应达到平衡状态,故a正确;b.c点为交点,气体物质的量分别相等,容器的体积相同,温度不同,体系中混合气体的压强不等,故b错误;c.该反应前后气体的体积不变,改变压强,平衡不移动,CO的转化率不变,故c正确;d.b点比d点温度低,生成物CO2体积分数大,说明反应进行的程度大,则化学平衡常数:Kb>Kd,故d错误;故答案为:bd。


科目:高中化学 来源: 题型:
【题目】氨是一种重要的化工原料。
Ⅰ、某学习小组同学设计了下图所示的实验装置(部分夹持仪器未画出),进行氨气实验室制备且探究氨气的还原性及产物的检验。
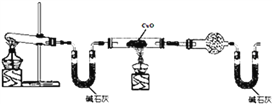
实验现象为:黑色CuO变为红色;干燥管中无水CuSO4粉末变为蓝色;同时生成一种无色无味无污染的气体。
(1)请写出大试管中反应的化学方程式_______________________________________。
(2)请写出氨气与CuO反应的化学方程式_________________________________________。
(3)该装置存在明显缺陷,请指出存在的问题______________________。
Ⅱ、哈伯因为将氮气和氢气在一定条件下合成氨气的成果面获得1918年诺贝尔化学奖。现将1molN2和3molH2充入一恒容的密闭容器中,使其在一定条件下达到平衡N2+3H2![]() 2NH3,下列哪些状态一定是达到平衡的状态?(_____)
2NH3,下列哪些状态一定是达到平衡的状态?(_____)
A.混合气体的平均相对分子质量不随时间改变而改变的状态
B.N2、H2、NH3的总物质的量不随时间改变而改变的状态
C.混合气体的密度不随时间改变而改变的状态
D.单位时间内0.1molNH3分解的同时,有0.05molN2生成的状态
Ⅲ、下图是一种电化学制备NH3的装置,图中陶瓷在高温时可以传输H+。
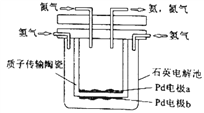
(1)H+经质子传输陶瓷由_____________流向_______________。(选填“a”或“b”)
(2)阴极发生的电极反应为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿魏酸在食品、医药等方面有着广泛用途。一种合成阿魏酸的反应可表示为
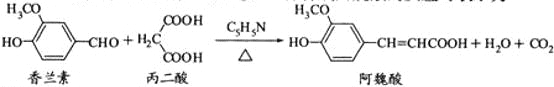
下列说法正确的是
A. 可用酸性![]() 溶液检测上述反应是否有阿魏酸生成
溶液检测上述反应是否有阿魏酸生成
B. 香兰素、阿魏酸均可与![]() 、
、![]() 溶液反应
溶液反应
C. 通常条件下,香兰素、阿魏酸都能发生取代、加成、消去反应
D. 与香兰素互为同分异构体,分子中有4种不同化学环境的氢,且能发生银镜反应的酚类化合物共有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学课上围绕浓硫酸的化学性质进行了如下实验探究,将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀,然后加入浓硫酸,生成黑色物质。
请回答下列问题:
(1)生成的黑色物质(单质)是_____(填化学式)。
(2)这种黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的主要污染物之一,这种刺激性气味的气体成分是_______(填化学式),反应的化学方程式为_________。
(3)据蔗糖与浓硫酸反应的实验现象,说明浓硫酸具有___________(填序号)。
A.酸性 | B.吸水性 | C.脱水性 | D.强氧化性 |
(4)将(2)中产生的有刺激性气味的气体通入品红溶液中,可以看到品红溶液_______,说明这种气体具有_______性;将(2)中产生的有刺激性气味的气体通入水中可生成一种不稳定、易分解的酸,请写出该反应的化学方程式:__________________________________________。
(5)能否用澄清石灰水鉴别这两种气体?_______(填“能”或“不能”),若不能,请填写两种能鉴别的试剂____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.25℃时,测得0.1mol/L的一元碱MOH溶液pH=11,则MOH一定为弱碱
B.25℃时,将pH=1的H2SO4溶液加水稀释10倍,所得溶液的c(SO42-)为0.005mol/L
C.25℃时,将![]() 的一元碱MOH溶液加水稀释至pH=10,所得溶液c(OH-)=10-4mol/L
的一元碱MOH溶液加水稀释至pH=10,所得溶液c(OH-)=10-4mol/L
D.25℃时,pH=12的一元碱MOH溶液与pH=2的盐酸等体积混合,所得溶液pH≤7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是次外层的3倍,金属元素Y原子核外无未成对电子, Z的单质晶体是应用最广泛的半导体材料,W与X位于同一主族。下列说法不正确的是
A.W的最高价氧化物对应的水化物是强酸
B.X的简单气态氢化物的沸点比W的高
C.Y的第一电离能比同周期相邻元素的大
D.1mol单质Z中共价键的数目约为4×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中含有CO、NOx等污染物,减少汽车尾气污染是重要研究课题。
(1)已知: N2(g) + O2(g)==2NO(g) △H=+ 180.5kJ·mol-1
2C(s)+ O2(g)== 2CO(g) △H= - 221.0kJ·mol-1
C(s)+ O2(g)==CO2(g) △H= -393.5 kJ·mol-1
2CO(g)+ 2NO(g)== N2(g)+ 2CO2(g) △H=_______kJ·mol-1
(2)某温度下,为探究2CO(g)+ 2NO(g)N2(g)+ 2CO2(g)的反应速率,用气体传感器测得不同时间的CO和NO浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(CO)/10-4mol·L-1 | 36.0 | 30.5 | 28.5 | 27.5 | 27.0 | 27.0 |
c(NO)/10-4mol·L-1 | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
①前2s内,上述反应的平均反应速率v(NO)=_______;
②该温度下,上述反应的平衡常数K=_________;
③对于上述反应,下列叙述正确的是________(填字母)。
A.反应在低温下能自发进行 B.当2v正(CO)=v逆(N2)时,反应达到平衡状态
C.研究反应的高效催化剂意义重大 D.反应达到平衡时,CO、NO的转化率相等
(3)CO浓度分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。写出多孔电极a的电极反应式:_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)在常温常压下为有臭鸡蛋气味的无色气体,广泛应用于农药、医药和其他化工生产中,存在于煤、石油和天然气中的羰基硫会腐蚀设备、污染环境,更会危害人体健康,工业上处理羰基硫常见的方法有水解反应和氢解反应。
(1)已知羰基硫中所有原子最外层均达到8电子结构,则其结构式为________________。
(2)①已知:H2(g)+COS(g)![]() H2S(g)+CO(g)△H1=+6.2kJ·mol-1;
H2S(g)+CO(g)△H1=+6.2kJ·mol-1;
②H2(g)+CO2(g)![]() H2O(g)+CO(g)△H2=+41.2kJ·mol-1;
H2O(g)+CO(g)△H2=+41.2kJ·mol-1;
则COS水解反应的热化学方程式为H2O(g)+COS(g)=H2S(g)+CO2(g),△H=___________kJ/mol.
②已知:COS水解反应的机理如下,其中吸附在催化剂表面的物种用*标注。
a. 吸附:H2O→H2O*
b. 反应:COS+H2O*→CO2+H2S*
c. 脱附:H2S*→H2S
已知COS水解反应的反应速率由b决定,则a、b、c三步中活化能最大的是__________________。
(3)已知COS氢解反应的热化学方程式为H2(g)+COS(g)![]() H2S(g)+CO(g) △H=+6.2kJ·mol-1,一定温度下,向某恒容密闭容器中充入4molCOS(g)和6molH2(g)发生氢解反应,H2、COS的体积分数
H2S(g)+CO(g) △H=+6.2kJ·mol-1,一定温度下,向某恒容密闭容器中充入4molCOS(g)和6molH2(g)发生氢解反应,H2、COS的体积分数![]() 随时间变化的关系如图所示,
随时间变化的关系如图所示,
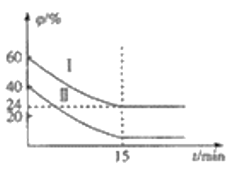
①H2的平衡转化率为_________________,
②该温度下,反应的平衡常数K为__________________,
③其他条件不变,20min时,向该容器中充入2molH2和3molCO,此时v(正)______________v(逆)(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质结构的命题中,错误的项数有
①CH3COOH分子中碳原子的杂化类型有sp2和sp3两种
②元素Ge位于周期表第四周期IVA族,核外电子排布式为[Ar]4s24p2,属于P区
③非极性分子往往具有高度对称性,如BF3、H2O2、CO2这样的分子
④冰中存在极性共价键和氢键两种化学键的作用
⑤Cu(OH)2是一种蓝色絮状沉淀,既溶于硝酸、氨水,也能溶于硫酸氢钠溶液中
⑥熔融态的HgCl2不导电,HgCl2稀溶液有弱的导电能力说明固态HgCl2是共价化合物,为非电解质
⑦氨水中大部分NH3与H2O以氢键(用“...”表示)结合成NH3·H2O分子,根据氨水的性质可知NH3.H2O的结构式可记为:
A.4项B.5项C.6项D.7项
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com