
【题目】下列各组离子能在溶液中大量共存的是( )
A.Na+、Mg2+、Cl﹣、OH﹣
B.H+、Ca2+、CO32﹣、NO3﹣
C.Na+、HCO3﹣、OH﹣、Ca2+
D.Cu2+、K+、SO42﹣、NO3﹣
科目:高中化学 来源: 题型:
【题目】关于SO2的叙述中,正确的是( )
A.SO2的摩尔质量是64g
B.1molSO2中所含分子数约为6.02×1023
C.1molSO2的质量是64g/mol
D.常温常压下,1mol SO2的体积为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对某难溶电解质AnBm的饱和溶液中,下列说法正确的是
A. 加同温度的水,其溶度积减小、溶解度增大
B. 升高温度,它的溶解度和溶度积都增大
C. 饱和溶液中c(Am+)=c(Bn﹣)
D. 加同温度的水,其溶度积、溶解度均不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构如图所示,下列说法正确的是
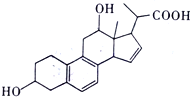
A. 该有机物的分子式为C21H24O4
B. 该有机物共有四种官能团,分别是:羟基、羧基、苯环、碳碳双键
C. 该有机物最多消耗NaOH与NaHCO3的物质的量比为1:1
D. 1mol 该有机物与足量金属钠反应,生成33.6L氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氨的合成是最重要的化工生产之一,工业上合成氨用的H2有多种制取的方法。用天然气跟水蒸气反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g)。已知有关反应的能量变化如下图所示,则此制取H2反应的ΔH=____________。
CO(g)+3H2(g)。已知有关反应的能量变化如下图所示,则此制取H2反应的ΔH=____________。
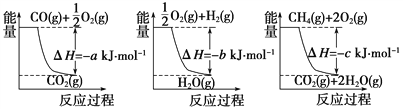
(2)已知通常状况下,每充分燃烧1gCO并恢复到原状态,会释放10KJ的热量。请写出表示CO燃烧热的热化学反应方程式:________________________________。
(3)一种甲烷燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接通入甲烷,同时向一个电极通入空气。此电池的负极电极反应式是_______________。
(4)利用右图装置可以模拟铁的电化学防护。
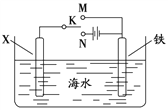
① 若X为碳棒,为减缓铁的腐蚀,开关K应置于______处。假设海水中只有NaCl溶质,写出此时总离子反应方程式:__________________________________________。
② 若X为锌,开关K置于M处,该电化学防护法称为_________。写出铁电极处的电极反应式:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
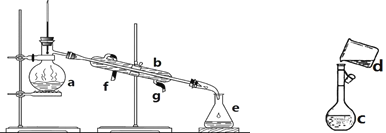
(1)写出下列仪器的名称:a. __________,b. __________,c. ___________。
(2)仪器a~e中,使用前必须检查是否漏水的有____________________________。(填序号)
(3)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是_______________,将仪器补充完整后进行的实验操作的名称为:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镓是制作高性能半导体的重要原料。在工业上经常从锌矿冶炼的废渣中回收镓。已知锌矿渣中含有Zn、Fe、Pb、Ga以及二氧化硅等,目前综合利用锌矿渣的流程如下:
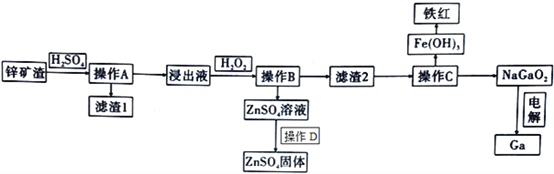
已知:①Ga性质与铝相似。
②lg2=0.3,lg3=0.48。
③如下表所示。
Zn(OH)2 | Ga(OH)3 | Fe(OH)2 | Fe(OH)3 | |
Ksp | 1.6×10-17 | 2.7×10-31 | 8×10-16 | 2.8×10-39 |
(1)写出Ga的原子结构示意图______________________________。
(2)滤渣1的成分为________________________。
(3)加入H2O2的目的( 用离子方程式和适当语言回答) ____________________________________。
(4)室温条件下,若浸出液中各种阳离子的浓度均为0.01mo/L且某种离子浓度小于1×10-5 mol/L即认为该离子已完全除去,问操作B调节pH的范围是________________________。
(5)操作C中,需要加入氢氧化钠溶液,其目的是_____________________ (用离子方程式解释);能否用氨水代替NaOH溶液,为什么? ________________________;如何检测Fe(OH)3洗涤干净? ________________________。
(6)在工业上,经常用电解NaGaO2溶液的方法生产Ga,写出阴极的电极反应方程式:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2018·天津市十二重点中学毕业班联考)已知:25℃时H2C2O4的pKa1=1.22,pKa2=4.19,CH3COOH的pK a=4.76,K代表电离平衡常数,pK = -1gK。下列说法正确的是
A. 浓度均为0.1mol·L-1NH4HC2O4和CH3COONH4溶液中:c(NH4+)前者小于后者
B. 将0.1mol·L-1的K2C2O4溶液从25℃升温至35℃,![]() 减小
减小
C. 0.1 mol·L-1K2C2O4溶液滴加盐酸至pH=1.22:c(H+)-c(OH-)=c(Cl-)-3c(HC2O4-)
D. 向0.1 mol·L-1CH3COONa溶液中滴加少量0.1 mol·L-1H2C2O4溶液:CH3COO- + H2C2O4 = CH3COOH + HC2O4-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com