
【题目】硼、镁及其化合物在工农业生产中应用广泛。已知:硼镁矿主要成分为Mg2B2O5·H2O, 硼砂的化学式为Na2B4O7·10H2O。利用硼镁矿制取金属镁及粗硼的工艺流程如下:

回答下列有关问题:
(1)硼砂中B的化合价为__________,溶于热水后,常用H2SO4调pH到2~3制取H3BO3,反应的离子方程式为__________________。
(2)氧化物X为H3BO3晶体加热脱水的产物,其与Mg反应制取粗硼的化学方程式为______________,该反应中的氧化剂是(填化学式)_______________。
(3)硼酸是一种一元弱酸,它与水作用时结合水电离的OH-而释放出水电离的H+,这一变化的化学方程式为____________________。皮肤上不小心碰到氢氧化钠溶液,一般先用大量水冲洗,然后再涂上硼酸溶液,则硼酸与氢氧化钠反应的离子方程式为 。
(4)MgCl2·7H2O需要在HCl氛围中加热制MgCl2,其目的是 。
【答案】
(1)+3(2分)B4O72-+2H++5H2O==4H3BO3(2分)
(2)3Mg+B2O3![]() 2B+3MgO(2分) B2O3(2分)
2B+3MgO(2分) B2O3(2分)
(3)H3BO3+H2O![]() [B(OH)4]-+H+(2分) H3BO3+OH-===[B(OH)4]-(2分)
[B(OH)4]-+H+(2分) H3BO3+OH-===[B(OH)4]-(2分)
(4)防止MgCl2水解生成Mg(OH)2(2分)
【解析】
试题分析:(1)根据硼砂的化学式Na2B4O7·10H2O和化合价的代数和为0,可得B的化合价为+3;B4O72-与H+反应可得H3BO3,离子方程式为:B4O72-+2H++5H2O==4H3BO3;
(2)X为H3BO3晶体加热脱水的产物,为B2O3,与Mg发生氧化还原反应制取粗B,则化学方程式为:3Mg+B2O3![]() 2B+3MgO,该反应中B元素的化合价由+3价降低到0价,则该反应中的氧化剂是B2O3。
2B+3MgO,该反应中B元素的化合价由+3价降低到0价,则该反应中的氧化剂是B2O3。
(3)由题意可知硼酸与水作用时结合水电离的OH-而释放出水电离的H+,所以这一变化的化学方程式为H3BO3+H2O![]() [B(OH)4]-+H+,硼酸是一种一元弱酸,能与氢氧化钠反应,其反应方程式为 H3BO3+NaOH=Na[B(OH)4],离子方程式为 H3BO3+OH-===[B(OH)4]-,
[B(OH)4]-+H+,硼酸是一种一元弱酸,能与氢氧化钠反应,其反应方程式为 H3BO3+NaOH=Na[B(OH)4],离子方程式为 H3BO3+OH-===[B(OH)4]-,
(4)MgCl2为强酸弱碱盐,能发生水解反应,所以MgCl2·7H2O在HCl氛围中加热的目的是防止MgCl2水解生成Mg(OH)2 。


科目:高中化学 来源: 题型:
【题目】已知X、Y均为有刺激性气味的气体,且几种物质间有以下转化关系,部分产物未标出。请回答下列问题。

(1)写出下列各物质的化学式:X 、Y 、C 。
(2)反应①的化学方程式为 ,反应②的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式的是
A.用惰性电极电解MgCl2溶液:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B.向石灰水中滴加少量Ca(HCO3)2溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
C.过氧化钠与水反应:2O22-+2H2O=4OH-+O2↑
D.一定量明矾溶液中滴加Ba(OH)2溶液至沉淀的质量最大时:
2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在生物体内含量极少,且必不可少的化学元素是
A. Fe Mn Zn Mg B. Zn Cu Mn Ca C. H O Na Mg D. Zn Cu B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C是三种常见短周期元素的单质。常温下D为无色液体,E是一种常见的温室气体。其转化关系如图所示(反应条件和部分产物略去)。下列说法中不正确的是
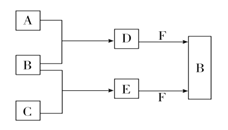
A.F中阴阳离子个数比为1:1
B.化合物F中既有离子键又有共价键
C.合成过程中的反应均是氧化还原反应
D.1mol F与E反应时转移的电子数为NA(NA为阿伏伽德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。

(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是 。
②称取样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是______________________。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为____________ 、 。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,请回答下列问题。
①若加热反应后不鼓入空气,对测定结果的影响是NaCl________NaHCO3__________ Na2CO3·10H2O__________(填“偏大”“偏小”或“无影响”)
②E处干燥管中盛放的药品是___________,其作用是__________ ,如果实验中没有该装置,则会导致测量结果NaHCO3的质量分数___________(填写同①)。
③若样品质量为10.0 g,反应后C、D装置增加的质量分别为2.7 g、2.2 g,则混合物中Na2CO3·10H2O的质量分数为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期主族元素的原子序数依次增大。A是元素周期表中原子半径最小的元素;B元素的原子最外层电子数是次外层电子数的2倍;D与A能形成两种原子个数比分别为1:1和1:2的共价化合物X和Y;D还能与E形成两种原子个数比分别为1:1和1:2的离子化合物M和N;F的最高正化合价为+6。
回答下列问题:
(1)C元素的化学名称为____________,F元素的化学名称为____________。
(2)Y的电子式为____________,M中阴离子的离子符号为___________。
(3)由以上六种元素中的两种原子构成的五核10e-分子的空间构型是______________。
(4)用电子式表示化合物E2F的形成过程为____________________。
(5)D、F的简单氢化物的沸点高低为____________(用化学式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C三种化合物,各取40克相混合,完全反应后,得18克B、49克C、还有D生成,已知D的相对分子量为106,现将22克A和11克B反应,能生成D的物质的量为 ( )
A. 1mol B. 0.5mol C. 0.275mol D. 0.25mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨作电极电解1 mol/L CuSO4溶液,当c(Cu2+)为0.5 mol/L时,停止电解,向剩余溶液中加入下列何种物质可使电解质溶液恢复至原来状态( )
A. CuCO3 B. CuSO4 C. Cu(OH)2 D. CuSO4·5H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com