
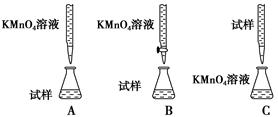
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。为测定补血剂中铁元素的含量,某化学兴趣小组设计了两套实验方案:
方案一 滴定法 用酸性KMnO4溶液滴定测定铁元素的含量。
反应原理:5Fe2++MnO4—+8H+===5Fe3++Mn2++4H2O
(1)实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需________(填仪器名称)。
(2)上述实验中KMnO4溶液需要酸化,用于酸化的酸是________。
| A.稀硫酸 | B.浓硝酸 | C.稀硝酸 | D.稀盐酸 |

科目:高中化学 来源: 题型:填空题
工业上以锂辉石(Li2O·Al2O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:
已知:①Li2O·Al2O3·4SiO2 H2SO4(浓)
H2SO4(浓) Li2SO4
Li2SO4 Al2O3·4SiO2·H2O↓
Al2O3·4SiO2·H2O↓
②某些物质的溶解度(S)如下表所示:
| T/℃ | 20 | 40 | 60 | 80 |
 (Li2CO3)/g (Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
 (Li2SO4)/g (Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(15分) (1)某兴趣小组欲准确配制一定物质的量浓度的NaOH溶液:快速准确称取8.0 g 纯净的NaOH固体,配制成100 mL溶液,该NaOH溶液的物质的量浓度为 。所需的仪器除托盘天平、钥匙、小烧杯、玻璃棒外还缺少 。
(2)有机物X由C、H、O三种元素组成的,为确定其结构进行如下实验:
a.6.0 g X在一定条件下完全分解,生成3.36 L(标准状况下)一氧化碳和1.8 g水;
b.中和2.4 g 有机物X需消耗上述NaOH溶液20.00 mL;
c.0.1 mol有机物X完全转化为酯,需要乙醇9.2 g,0.1 mol X能与足量钠反应放出3.36 L(标准状况下)氢气。则:
①X的相对分子质量为 。
②X的分子式为 。
③写出X的结构简式: 。
④写X与足量乙醇发生酯化反应的方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某同学用下列装置(固定、加热仪器和橡胶管已经省略)进行有关气体制取及其相关实验的探究,回答下列问题.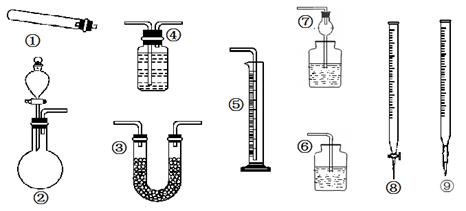
(1)若用装置①制取NH3,其反应的化学方程式为 ;多余的氨气应选用 装置吸收。(填装置序号,下同)
(2)若用装置②制乙炔,其反应的化学方程式为 ;要测定生成乙炔的体积,则必须选择的装置是 ,因制取的乙炔常含有杂质,若要除去杂质,所选装置中应盛放的试剂为: 。
(3)若用装置②制取乙烯,少了一种重要仪器 _。
(4)若用0.01mol/L的酸性高锰酸钾溶液滴定未知浓度的草酸溶液,酸性高锰酸钾溶液应装在装置 中。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(1)某学生欲用11.9 mol·L-1的浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol·L-1的稀盐酸。该学生需要量取________mL浓盐酸进行配制。(保留小数点后1位)
(2)容量瓶是配制溶液的必需仪器。下列关于容量瓶及其使用方法的叙述,错误的是
①是配制一定物质的量浓度的溶液的专用仪器
②使用前要先检查容量瓶是否漏液
③容量瓶可以用来加热
④不能用容量瓶长期贮存配制好的溶液
⑤可以用500mL容量瓶配制250mL溶液
⑥容量瓶上标有的是温度 、容量 、刻度线
a.① ③ b.① ④ c.③ ⑤ d.⑤ ⑥
(3)① 该同学用配制的0.400 mol·L-1的盐酸,中和含0.4 g NaOH的NaOH溶液,则该同学需取________mL盐酸。
② 假设该同学用新配制的盐酸中和含0.4 g NaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是________。
a.浓盐酸挥发,浓度不足
b.配制溶液时,未洗涤烧杯
c.配制溶液时,俯视容量瓶刻度线
d.加水时超过刻度线,用胶头滴管吸出
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验需要0.1 mol/L NaOH溶液450 mL,根据溶液配制中的情况回答下列问题:
(1)实验中除了托盘天平、烧杯、容量瓶外还需要的其他仪器有___ ___
_______________________________________________ __________。
(2)根据计算得知,所需NaOH的质量为________g。
(3)配制一定物质的量浓度溶液的实验中,如果出现以下操作
| A.称量时用了生锈的砝码 |
| B.将NaOH放在纸张上称量 |
| C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中 |
| D.往容量瓶转移时,有少量液体溅出 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验室制备苯乙酮的化学方程式为:
制备过程中还有CH3COOH+AlCl3―→CH3COOAlCl2+HCl↑等副反应。
主要实验装置和步骤如下:
(Ⅰ)合成:在三颈瓶中加入20g无水三氯化铝和30mL
无水苯。为避免反应液升温过快,边搅拌边慢慢滴加6mL
乙酸酐和10mL无水苯的混合液,控制滴加速率,使反应液
缓缓回流。滴加完毕后加热回流1小时。
(Ⅱ)分离与提纯:①边搅拌边慢慢滴加一定量浓盐酸与冰水混合液,分离得到有机层②水层用苯萃取,分液③将①②所得有机层合并,洗涤、干燥、蒸去苯,得到苯乙酮粗产品④蒸馏粗产品得到苯乙酮
回答下列问题:(1)仪器a的名称:________;装置b的作用:________。
(2)合成过程中要求无水操作,理由是_______________________。
(3)若将乙酸酐和苯的混合液一次性倒入三颈瓶,可能导致________。
| A.反应太剧烈 | B.液体太多搅不动 | C.反应变缓慢 | D.副产物增多 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。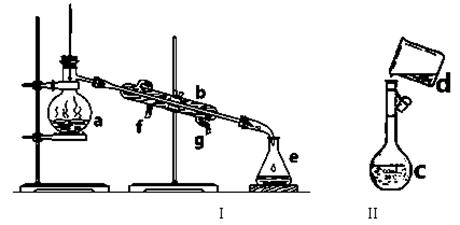
⑴写出下列仪器的名称:a. b. c.
⑵仪器a~c中,使用前必须检查是否漏水的有 。(填序号)
⑶若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是 ,
将仪器补充完后进行实验,温度计水银球的位置在 处。
冷凝水由 (填f或g)口通入。
(4)现需配制0.1mol/LNaOH溶液450mL,装置II是某同学转移溶液的示意图。
①图中的错误是 。除了图中给出的的仪器和分析天平外,为完成实验还需要的仪器有: 。
②配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) ________。
| A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶 |
| B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解 |
| C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中 |
| D.将容量瓶盖紧,振荡,摇匀 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
纯碱(Na2CO3)在生产生活中具有广泛的用途。以下是实验室模拟制碱原理制取Na2CO3的流程图
已知:向饱和食盐水中通入NH3,CO2后发生和反应为NaCl+NH3+CO2+H2O NaHCO3↓+NH4Cl,请回答以下问题:
NaHCO3↓+NH4Cl,请回答以下问题:
(1)粗盐中含有的杂质离子有Ca2+,Mg2+,SO42-等。
精制除杂的步骤顺序a→_______→________→________→b(填字母编号)。
a.粗盐溶解,滤去沉渣.b.加入盐酸调pH;c.加入Ba(OH)2溶液;d.加入Na2CO3溶液;e.过滤
向饱和食盐水中先通入NH3,后通人CO2,理由是_____________________。
(2)灼烧固体A制Na2CO3在_____填字母序号)中进行。
a.坩埚 b.蒸发皿 c.烧杯 d.锥形瓶
证明滤液A中含有NH4+的方法是__________________________________________________________。
对滤液A进行重结晶能够获得NH4HCO3,向pH=13含Na+,K+的溶液中加入少量NH4HCO3。使pH降低,反应的离子方程式____________________________________。
(3)下图装置中常用于实验室制备CO2的是_____(填字母编号);用b示意的装置制备NH3,分液漏斗中盛放的试剂______(填试剂名称),烧瓶内可加入的固体试剂__________(填试剂名称)。
(4)一种天然碱晶体成分是aNa2CO3·bNa2CO3·cH2O,某同学利用下列提供的试剂,设计了如下简单合理测定Na2CO3的质量分数的实骏方案。(仪器自选)请把实验方案填全:供选择的试剂:1.0mol/LH2SO4溶液、1.0mol/L BaCl2溶液、稀氨水、碱石灰、Ca(OH)2溶液、蒸馏水
①称取m1g一定量天然碱晶体样品,溶于适量蒸馏水中。
②_________________________________________________________________。
③_________________________________________________________________。
④计算天然碱晶体中含Na2CO3的质量分数。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com