
【题目】NaClO是漂白液的有效成分,某研究小组探究NaClO溶液的性质,设计了下列实验:
装置图 | 试剂X | 实验现象 | |
| ① | 0.2 mol·L-1盐酸 | 产生黄绿色气体 |
② | 0.2 mol·L-1 KI-淀粉溶液 | 溶液变蓝 | |
③ | 0.2 mol·L-1FeSO4(H+)和KSCN混合溶液 | 溶液变红 | |
④ | 0.2mol·L-1AlCl3溶液 | 产生白色沉淀 | |
下列判断不正确的是
A. 实验①中发生的反应:ClO-+Cl-+2H+=Cl2↑+H2O
B. 实验②中发生的反应:ClO-+2I-+2H+=Cl-+I2+H2O
C. 实验③中该条件下氧化性强弱:ClO->Fe3+
D. 实验④中ClO-与Al3+相互促进水解
【答案】B
【解析】
A. NaClO具有强的氧化性,在酸性溶液中能够与Cl-发生氧化还原反应,产生氯气,反应的离子方程式为:Cl-+2H++ClO-=Cl2↑+H2O,A正确;
B.向KI-淀粉溶液中滴入NaClO溶液,会发生反应:ClO-+2I-+H2O=Cl-+I2+2OH-,但产生的I2会立即与溶液产生的OH-发生反应,因此不能使溶液变为蓝色,B错误;
C.在酸性条件下,ClO-将Fe2+氧化为Fe3+,Fe3+遇SCN-,溶液变为血红色,因此会看到溶液变为红色,C正确;
D. AlCl3是强酸弱碱盐,水解产生Al(OH)3,使溶液显酸性; NaClO是强碱弱酸盐,ClO-水解消耗水电离产生的H+,使溶液显碱性,当将NaClO溶液滴入AlCl3溶液中时,水解相互促进,产生氢氧化铝白色沉淀,D正确;
故合理选项是B。


科目:高中化学 来源: 题型:
【题目】一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数表达式为:Ksp=cm(An+)·cn(Bm-),称为难溶电解质的溶度积。已知25 ℃时,以下五种物质的Ksp:
物质 | AgCl | Ag2CrO4 | AgBr | AgI | Ag2S |
Ksp | 2×10-10 | 2×10-12 | 5.4×10-13 | 8.3×10-17 | 6.3×10-50 |
颜色 | 白色 | 砖红色 | 淡黄色 | 黄色 | 黑色 |
现以0.1 mol·L-1的AgNO3溶液测定某溶液中c(Cl-),适宜作滴定指示剂的物质是( )
A. K2CrO4 B. KBr C. KI D. K2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸晶体的组成可用H2C2O4·2H2O(M=126g/mol)表示,其中混有不参与反应的杂质,为了测定草酸晶体的纯度,进行如下实验:称取m g样品,配成250mL水溶液。量取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为c mol·L-1的KMnO4溶液滴定,所发生的反应: KMnO4+ H2C2O4+ H2SO4 = K2SO4+ CO2↑+ MnSO4+ H2O。试回答:
(1)写出该反应的离子方程式并配平:_________________________________________,该反应发生时产生气体先慢后快的原因是_______________________________________________
(2)实验中,KMnO4溶液应装在_____式滴定管中,因为 ___________________。
(3)滴定过程中需要加入的指示剂为___________(填指示剂的名称或“不需要”),确定反应达到滴定终点时的现象是______________________________________。
(4)下列操作会导致测定结果偏低的是_________________________。
A.盛标准溶液的滴定管用蒸馏水洗涤后未用标准液润洗就装液滴定
B.锥形瓶用蒸馏水洗涤后未用待测液润洗
C.读取标准液读数时,滴定前平视,滴定到终点后俯视
D.滴定前滴定管尖嘴处有气泡未排除,滴定后气泡消失
(5)在滴定过程中若用c mol·L-1的KMnO4溶液V mL,则所配制的草酸溶液的物质的量浓度为___mol·L-1,由此可计算样品中草酸晶体的纯度是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向0.1mol/LNaA溶液中逐滴滴加盐酸,测得混合溶液的pH与![]() 变化关系如图所示p
变化关系如图所示p![]() =-lg
=-lg![]() 。下列叙述错误的是
。下列叙述错误的是

A. E点溶液中c(Na+)=c(A-)
B. Ka(HA)的数量级为10-4
C. 滴加过程中![]() 保持不变
保持不变
D. F点溶液中c(Na+)>c(A-)>c(HA)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,难溶电解质的饱和溶液中存在着沉淀溶解平衡,已知:
物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
Ksp(25 ℃) | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
25 ℃时,对于含Fe2(SO4)3、FeSO4和CuSO4各0.5 mol的1 L混合溶液,根据上表数据判断,下列说法不正确的是( )
A. 在pH=5的溶液中,Fe3+不能大量存在
B. 混合溶液中c(SO![]() )∶[c(Fe3+)+c(Fe2+)+c(Cu2+)]>5∶4
)∶[c(Fe3+)+c(Fe2+)+c(Cu2+)]>5∶4
C. 向混合溶液中逐滴加入0.1 mol·L-1NaOH溶液,最先看到红褐色沉淀
D. 向混合溶液中加入适量氯水,并调节pH到3~4过滤,可获较纯净的CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为二氧化锰的有关转化关系图,下列有关说法中不正确的是( )
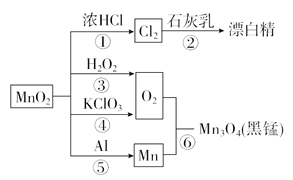
A. 反应①~⑥均属于氧化还原反应
B. 反应⑤中氧化剂与还原剂的物质的量之比为3∶4
C. 相同条件下生成等量的O2,反应③和④转移的电子数之比为1∶1
D. 反应①生成的Cl2经干燥后,可用钢瓶贮运
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一包白色固体粉末,其中可能含有NaCl、Ba(NO3)2、CuSO4、Na2CO3、KNO3中的一种或几种,现做以下实验:
①将部分粉末加入水中,振荡,有白色沉淀生成,过滤后溶液呈无色;
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生;
④另取①中过滤后的溶液加入足量硝酸酸化的AgNO3溶液产生白色沉淀。
试根据上述实验事实,回答下列问题:
(1)原白色粉末中一定含有的物质是________,一定不含的物质是________,可能含有的物质是________。(以上各种物质均写化学式)
(2)写出下列步骤中发生反应的离子方程式:
①_______________________________________________________;
②_______________________________________________________;
④_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温下pH=2的盐酸甲和pH=2的醋酸溶液乙,请根据下列操作回答问题:
(1)常温下0.lmol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是__________
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D.c(OH-)/c(H+)
(2)取10mL乙溶液,加入等体积水,醋酸的电离平衡___________(填“向左”、“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体 (假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中c(H+)/c(CH3COOH)的比值将___________(填“增大”“ 减小”或“无法确定”)。
(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲)___________V(乙) (填“>”、“ <”或“=”)。
(4)已知25℃时,两种酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数K1 | 1.8×l1-5 | 4.3×l0-7 | 3.0×10-8 |
K2 | - - | 5.6×10-11 | - - |
下列四种离子结合H+能力最强的是___________;
A.HCO3- B.CO32- C.ClO- D.CH3COO-
(5)常温下,取甲溶液稀释100倍,其pH=___________;取99mL甲溶液与lrnLlmol/L的NaOH溶液混合(忽略溶液体积变化),恢复至常温时其pH=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将HI(g)置于密闭容器中,某温度下发生下列变化2HI(g)H2(g) + I2(g) ΔH<0
(1)该反应平衡常数的表达式为K____________,则H2(g)+ I2(g)2HI(g) 平衡常数的表达式为K1=____________(用K表示)。
(2)能判断该反应达到平衡状态的依据是____________
A.容器中压强不变 B.混合气体中c(HI)不变
C.c(I2)=c(H2) D.v(HI)正=v(H2)逆
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com