
【题目】能源与人类的生存和发展息息相关,化学反应在人类利用能源的历史过程中充当重要的角色。回答下列问题:
(1)科学家最近研制出利用太阳能产生激光,使海水分解。太阳光分解海水时,光能转化为________能,水分解时断裂的化学键是________(填“离子键”或“共价键”)
(2)氢能是一种具有发展前景的理想清洁能源,氢气燃烧时放出大量的热。若断开1mol氢气中的化学键消耗的能量为Q1kJ,断开1mol氧气中的化学键消耗的能量为Q2kJ,形成1mol水中的化学键释放的能量为Q3kJ,则下列关系正确的是____________
A.Q1+Q2<Q3 B.2Q1+Q2<2Q3
C.2Q1+Q2>2Q3 D.Q1+Q2>Q3
(3)下列化学反应在理论上可以设计成原电池的是________。
A.Fe+2FeCl3=3FeCl2 B.SO3+H2O=H2SO4
C.C+H2O![]() CO+H2 D.Ba(OH)2+H2SO4=BaSO4+2H2O
CO+H2 D.Ba(OH)2+H2SO4=BaSO4+2H2O
(4)美国NASA曾开发一种铁·空气电池,其原理如图所示,电池反应为:2Fe+O2+2H2O=2Fe(OH)2。

①电极a为原电池的________(填“正极”或“负极”),该极的电极反应式为______________________;电极b上发生________反应(填“氧化”或“还原”)。
②原电池工作一段时间后,若消耗铁22.4g,则电路中通过的电子数为________。
【答案】化学 共价键 B A 负极 Fe-2e—+2OH—=Fe(OH)2 还原 0.8NA或0.8×6.02×1023
【解析】
(1)利用太阳光分解海水生成氢气和氧气,水是共价化合物,含有共价键;
(2)放热反应,断裂化学键吸收的能量小于形成化学键释放的能量;
(3)放热的氧化还原反应能设计成原电池;
(4)①a电极,Fe→Fe(OH)2 ,铁失电子化合价升高;b电极,氧气得电子生成氢氧根离子;
②原电池工作时,铁元素化合价由0升高为+2;
(1)利用太阳光分解海水生成氢气和氧气,光能转化为化学能,水是共价化合物,含有共价键,水分解断裂的是共价键;
(2)放热反应,断裂化学键吸收的能量小于形成化学键释放的能量,2mol氢气和1mol氧气反应生成2mol水,氢气燃烧时放出大量的热,所以2Q1+Q2<2Q3,选B;
(3)A.Fe+2FeCl3=3FeCl2,铁元素化合价改变,有电子转移,反应放出能量,能设计成原电池,故选A;
B.SO3+H2O=H2SO4,没有化合价改变,没有有电子转移,不能设计成原电池,故不选B;
C.C+H2O![]() CO+H2,碳元素化合价改变,有电子转移,该反应吸收能量,不能设计成原电池,故不选C;
CO+H2,碳元素化合价改变,有电子转移,该反应吸收能量,不能设计成原电池,故不选C;
D.Ba(OH)2+H2SO4=BaSO4+2H2O,没有化合价改变,没有有电子转移,不能设计成原电池,故不选D;
(4)①a电极,Fe→Fe(OH)2 ,铁失电子化合价升高,a极电子流出,为原电池负极,电极反应式是Fe-2e-+2OH-=Fe(OH)2;b电极,氧气得电子生成氢氧根离子,b极发生还原反应;
②原电池工作时,铁元素化合价由0升高为+2,若消耗铁22.4g,则电路中通过的电子数为![]() 0.8NA。
0.8NA。


科目:高中化学 来源: 题型:
【题目】高纯活性氧化锌可用于光催化、光电极、彩色显影等领域。以工业级氧化锌(含Fe2+、Mn2+、Cu2+、Ni2+、Cd2+等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下:

已知Ksp[Fe(OH)3]=4.0×10-38。
回答下列问题:
(1)浸出时,为了提高浸出效率可采用的措施有(写两种):___________;___________。
(2)氧化时,加入KMnO4溶液是为了除去浸出液中的Fe2+和Mn2+(溶液中Mn全部转化为MnO2),请配平下列除去Fe2+的离子方程式:MnO![]() +Fe2++ ===MnO2↓+Fe(OH)3↓+H+ ____________
+Fe2++ ===MnO2↓+Fe(OH)3↓+H+ ____________
(3)加入锌粉的目的是_______________________________________________________。
(4)已知H2SO4浸出液中,c(Fe2+)=5.04 mg·L-1、c(Mn2+)=1.65 mg·L-1,加入KMnO4溶液反应一段时间后,溶液中c(Fe3+)=0.56 mg·L-1,若溶液pH=3,则此时Fe3+__________(填“能”或“不能”)生成沉淀。
(5) 已知:常温下,①Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11;②H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH的变化关系如图所示。

①比较H2R ,HR-,H2CO3三者的酸性强弱_________________________________
②NaHR溶液中存在![]() = _______________________
= _______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是( )
A. 2H2(g)+O2(g) == 2H2O(1) △H= ―285.8kJ/mol![]()
B. 2H2(g)+ O2(g) == 2H2O(1) △H= +571.6 kJ/mol
C. 2H2(g)+O2(g) == 2H2O(g) △H= ―571.6 kJ/mol
D. H2(g)+1/2O2(g) == H2O(1) △H= ―285.8kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将氯化铝溶液蒸干灼烧得到的固体物质是(填化学式)____________向纯碱溶液中滴入几滴酚酞会变红,原因是(用离子方程式表示)_______________ 。
(2)牙齿表面由一层坚硬的、组成为Ca5(PO4)3OH的物质保护着。它在唾液中存在下列平衡:Ca5(PO4)3OH(s)![]() 5Ca2++3PO43-+OH-。进食后细菌和酶作用于食物产生有机酸,这时牙齿就会受到腐蚀,其原因是_____________________________________________。
5Ca2++3PO43-+OH-。进食后细菌和酶作用于食物产生有机酸,这时牙齿就会受到腐蚀,其原因是_____________________________________________。
(3)1g碳与适量水蒸气反应生成CO和H2,需吸收10.94KJ热量,此反应的热化学方程式为_________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。
(1)太阳能热水器中常使用一种以镍或镍合金(含铁)空心球为吸收剂的太阳能吸热涂层,铁、镍基态原子未成对电子数各为_____________、________________。
(2)C60可用作储氢材料,已知金刚石中的C-C键的键长为0.154 nm,C60中C-C键键长为0.140~0.145 nm,有同学据此认为C60的熔点高于金刚石,你认为是否正确?_________,阐述理由:________________________________________________________________________。C60晶体(其结构模型如图)中每个C60分子周围与它距离最近且等距离的C60分子有_____个。
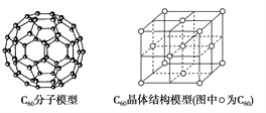
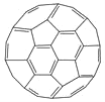
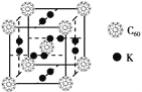
(3)富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途。富勒烯(C60)的结构如下图所示,分子中碳原子轨道的杂化类型为_________;1 mol C60分子中σ键的数目为________。科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。该物质的K原子和C60分子的个数比为________。
(4)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是______________。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为______个。
(5)请解释如下现象:熔点:Si60>N60>C60,而破坏分子所需要的能量: N60>C60>Si60,其原因是:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中发生如下反应 X(g)+3Y(g)![]() 2Z(g)ΔH<0。该反应的速率(v)随时间(t)变化的关系如下图所示,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。则下列说法中错误的是
2Z(g)ΔH<0。该反应的速率(v)随时间(t)变化的关系如下图所示,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。则下列说法中错误的是
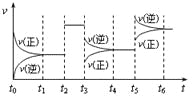
A. t2时加入了催化剂
B. t3时减小了体系压强
C. t5时升高了体系温度
D. t2、t3、t5变化后反应物转化率均比t1时减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(16分)工业上可以在恒容密闭容器中采用下列反应制备甲醇:
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
(1)下列情况可以作为判断反应达到平衡状态的依据的是(填序号) 。
A.生成CH3OH 的速率与消耗H2的速率之比为1︰2
B.混合气体的平均相对分子质量保持不变
C.混合气体的密度保持不变
D.体系内的压强保持不变
(2)下表所列数据为该反应在不同温度下的化学平衡常数:
温度/℃ | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
①反应的平衡常数表达式为K= 。由上表数据判断,该反应的△H 0(填“>”、“=”或“<”)。升高温度,正反应速率 (填“增大”、“减小”或“不变”)。
②某温度下,将2molCO和6molH2充入一个容积为2L的密闭容器中,达到平衡时c(H2)=1.4mol/L,则CO的转化率为 ,此时的温度为 。
(3)欲提高CO的转化率,可采取的措施是 。(填序号)
A.升温
B.加入更高效的催化剂
C.恒容条件下充入CO
D.恒容条件下充入H2
E.恒容条件下充入氦气
F.及时移走CH3OH
(4)一定条件下,CO和H2在催化剂作用下生成1molCH3OH的能量变化为90.8kJ。该温度下,在三个容积相同的密闭容器中,按不同方式投料,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 | |
投料方式 | 1molCO、2molH2 | 1molCH3OH | 2molCH3OH | |
平衡数据 | C(CH3OH)/(mol/L) | c1 | c2 | c3 |
体系压强(Pa) | p1 | p2 | p3 | |
反应的能量变化 | akJ | bkJ | ckJ | |
原料转化率 | α1 | α2 | α3 | |
下列分析正确的是 。(填序号)
A.2c1<c3 B.2 p1<p3C.|a|+|b|=90.8 D.α1+α3>1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,其元素特征信息如下表
元素 | 元素特征信息 |
A | 其单质是密度最小的物质。 |
B | 阴离子带两个单位负电荷,单质是空气的主要成分之一。 |
C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物。 |
D | 其氢氧化物和氧化物都有两性,与C同周期 |
E | 与C同周期,原子半径在该周期最小 |
回答下列问题:
(1)写出下列元素的名称:C___________,E______________
(2)写出A、B、C形成的化合物的电子式____________________
(3)B、C、D的简单离子半径由大到小的顺序是(用化学式表示)____________________
(4)写出E单质与A、B、C形成的化合物反应的化学方程式:__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组同学利用以下装置制备氨气,并探究氨气的性质(部分仪器已略去)。

请回答:
(1)该同学用镊子夹取湿润的红色石蕊试纸靠近试管口,可观察到试纸变蓝,该现象说明氨气溶于水,溶液呈___性。
(2)收集氨气时,请你选择氨气的进气口___(“a”或“b”)。
(3)若观察到装置B中的烧瓶内产生了红色喷泉,则说明氨气具有的性质是___。
(4)以下装置(盛放的液体均为水)可用于吸收多余氨气的是___(填序号)。
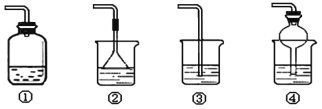
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com