
【题目】某化学实验小组同学利用以下装置制备氨气,并探究氨气的性质(部分仪器已略去)。

请回答:
(1)该同学用镊子夹取湿润的红色石蕊试纸靠近试管口,可观察到试纸变蓝,该现象说明氨气溶于水,溶液呈___性。
(2)收集氨气时,请你选择氨气的进气口___(“a”或“b”)。
(3)若观察到装置B中的烧瓶内产生了红色喷泉,则说明氨气具有的性质是___。
(4)以下装置(盛放的液体均为水)可用于吸收多余氨气的是___(填序号)。
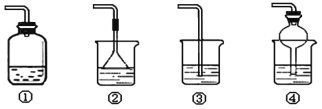
【答案】碱 a 极易溶于水,且与水反应生成一种碱性物质 ②④
【解析】
(1)利用氨气溶于水生成NH3·H2O进行分析;
(2)氨气的密度小于空气,收集时用向下排空气法收集,对此进行分析;
(3)根据(1)的分析;
(4)氨气极易溶于水,吸收时注意防倒吸;
(1)NH3极易溶于水,在水中有NH3++H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-,酚酞遇碱变蓝,因此该实验体现了溶液呈碱性;
NH4++OH-,酚酞遇碱变蓝,因此该实验体现了溶液呈碱性;
(2)氨气的密度小于空气的密度,收集时应向下排空气法收集,即从a口进气;
(3) 形成喷泉,说明烧瓶的压强突然减小,即推出NH3极易溶于水,酚酞遇碱变蓝,说明氨气溶于水后,生成一种碱性物质;
(4)氨气极易溶于水,可以用水吸收多余的氨气,吸收时应注意防治倒吸,故②④正确。


科目:高中化学 来源: 题型:
【题目】能源与人类的生存和发展息息相关,化学反应在人类利用能源的历史过程中充当重要的角色。回答下列问题:
(1)科学家最近研制出利用太阳能产生激光,使海水分解。太阳光分解海水时,光能转化为________能,水分解时断裂的化学键是________(填“离子键”或“共价键”)
(2)氢能是一种具有发展前景的理想清洁能源,氢气燃烧时放出大量的热。若断开1mol氢气中的化学键消耗的能量为Q1kJ,断开1mol氧气中的化学键消耗的能量为Q2kJ,形成1mol水中的化学键释放的能量为Q3kJ,则下列关系正确的是____________
A.Q1+Q2<Q3 B.2Q1+Q2<2Q3
C.2Q1+Q2>2Q3 D.Q1+Q2>Q3
(3)下列化学反应在理论上可以设计成原电池的是________。
A.Fe+2FeCl3=3FeCl2 B.SO3+H2O=H2SO4
C.C+H2O![]() CO+H2 D.Ba(OH)2+H2SO4=BaSO4+2H2O
CO+H2 D.Ba(OH)2+H2SO4=BaSO4+2H2O
(4)美国NASA曾开发一种铁·空气电池,其原理如图所示,电池反应为:2Fe+O2+2H2O=2Fe(OH)2。

①电极a为原电池的________(填“正极”或“负极”),该极的电极反应式为______________________;电极b上发生________反应(填“氧化”或“还原”)。
②原电池工作一段时间后,若消耗铁22.4g,则电路中通过的电子数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A(g)+B(g) ![]() C(g)+D(g)的平衡常数K值与温度的关系如表所示,830 ℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
C(g)+D(g)的平衡常数K值与温度的关系如表所示,830 ℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
温度/℃ | 700 | 830 | 1200 |
K值 | 1.7 | 1.0 | 0.4 |
A. 达到平衡后,B的转化率为50%
B. 增大压强,正、逆反应速率均加快
C. 该反应为吸热反应,升高温度,平衡正向移动
D. 反应初始至平衡,A的平均反应速率v(A)=0.005 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,属于氧化还原反应的是
A.Al2O3+6HCl=2AlCl3+3H2O
B.Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
C.2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
D.SiO2+2NaOH=Na2SiO3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:
Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH1=+489.0 kJ·mol-1,
C(s) +CO2(g)=2CO(g) ΔH2=+172.5kJ·mol-1
则CO(g)还原Fe2O3(s)的热化学方程式为____。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式:_____。
(3)将CO2和H2充入1L的密闭容器中,在两种温度下发生反应:
CO2(g) +3H2(g)![]() CH3OH(g) +H2O(g)测得CH3OH的物质的量随时间的变化见图1。
CH3OH(g) +H2O(g)测得CH3OH的物质的量随时间的变化见图1。
①该反应的平衡常数表达式为K=___。
②曲线I、Ⅱ对应的平衡常数大小关系为KⅠ___KⅡ(填“>”或“=”或“<”)。
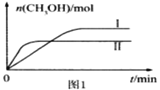
③一定温度下,往该容器中投入1 molCO2、3 mol H2 ,一段时间后达到平衡。若平衡后气体的压强为开始的0.8倍,则CO2的平衡转化率=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1) 同温同压下,同体积的NH3和H2S气体的质量比是________________;同质量的NH3和H2S气体的体积比是_____________,同质量的NH3和H2S气体中所含氢原子个数比是_____________,若两者所含氢原子个数相等,它们的物质的量比是__________;
(2)在100ml Al2(SO4)3溶液中含0.6molSO42-,从中取出1/4 体积的该溶液再稀释到100 ml,则稀释后的溶液中SO42-的物质的量浓度为_______________。。
(3)在氯化镁和硫酸镁的混合液中,若Mg2+与Cl-的物质的量浓度之比为4∶3时,则Mg2+与SO42-物质的量浓度之比为_____________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对图中的表述中正确的是( )
A.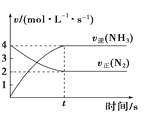 图中两条线的交点可表示反应N2(g)+3H2(g)2NH3(g)达到了平衡
图中两条线的交点可表示反应N2(g)+3H2(g)2NH3(g)达到了平衡
B. 图中所介绍的电池使用后埋入地下会污染土壤,应投入火中焚烧彻底销毁
图中所介绍的电池使用后埋入地下会污染土壤,应投入火中焚烧彻底销毁
C.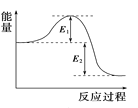 图可表示某化学反应属于放热反应,放出的能量为E1+E2
图可表示某化学反应属于放热反应,放出的能量为E1+E2
D.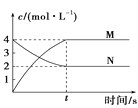 图涉及的反应可能为N(aq)2M(aq)
图涉及的反应可能为N(aq)2M(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸的工业制备是一个重要的化工生产过程,但同时在生产过程中会产生大量SO2等污染物。以硫酸工业的尾气、氨水、石灰石、焦炭及氯化钾为原料可以合成有重要用途的硫化钙、硫酸钾、氯化铵、亚硫酸铵等物质。请根据下图中的合成路线回答下列问题:
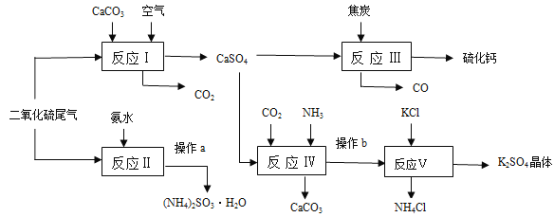
(1)生产中,常向反应II的溶液中加入强还原性的对苯二酚等物质,目的是__________。
(2)操作a中,必须的操作步骤有_______________、___________、过滤等。
(3)反应Ⅲ中氧化剂与还原剂的物质的量之比为__________。
(4)写出反应Ⅳ的化学方程式__________________________________________________;操作b所得滤液中阳离子的检验方法是________________。
(5)该生产过程中可以循环使用的物质是_______________。
(6)(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为N2,试写出二氧化氮与亚硫酸铵反应的化学方程式___________________________________________。
(7)某电厂每月用煤300t(煤中含硫的质量分数为2.5%),若燃烧时煤中的硫全部转化为二氧化硫,现用反应Ⅰ的原理将尾气中的SO2转化为石膏[M(CaSO4·2H2O)=172],且反应过程中96%的二氧化硫转化为石膏,则可生产石膏______ t。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 lmol碳完全燃烧后可放出393.5KJ的热量,下列热化学方程式正确的是( )
A.C(s)+O2(g)=CO2(g) △H=+393.5kJ/mol
B.C(s)+![]() O2(g)=CO(g) △H=﹣393.5kJ/mol
O2(g)=CO(g) △H=﹣393.5kJ/mol
C.C+O2=CO2 △H=﹣393.5kJ/mol
D.C(s)+O2(g)=CO2(g) △H=﹣393.5kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com