
【题目】(1)将氯化铝溶液蒸干灼烧得到的固体物质是(填化学式)____________向纯碱溶液中滴入几滴酚酞会变红,原因是(用离子方程式表示)_______________ 。
(2)牙齿表面由一层坚硬的、组成为Ca5(PO4)3OH的物质保护着。它在唾液中存在下列平衡:Ca5(PO4)3OH(s)![]() 5Ca2++3PO43-+OH-。进食后细菌和酶作用于食物产生有机酸,这时牙齿就会受到腐蚀,其原因是_____________________________________________。
5Ca2++3PO43-+OH-。进食后细菌和酶作用于食物产生有机酸,这时牙齿就会受到腐蚀,其原因是_____________________________________________。
(3)1g碳与适量水蒸气反应生成CO和H2,需吸收10.94KJ热量,此反应的热化学方程式为_________________________________________________________
【答案】Al2O3 CO32-+H2O![]() HCO3-+OH- 酸中和了OH-,促进溶解平衡右移 C(s)+H2O(g)=CO(g)+H2(g)△H=+131.28kJ·mol-1
HCO3-+OH- 酸中和了OH-,促进溶解平衡右移 C(s)+H2O(g)=CO(g)+H2(g)△H=+131.28kJ·mol-1
【解析】
(1)根据温度对水解平衡的影响分析;根据碳酸钠是强碱弱酸盐,碳酸根水解分析解答;
(2)依据外界条件对沉淀溶解平衡的影响因素分析;
(3)根据1g碳反应吸收的热量书写反应的热化学方程式。
(1)氯化铝水解生成氢氧化铝和盐酸,将氯化铝溶液加热蒸干,促进氯化铝水解,平衡向右移动,盐酸挥发,得到氢氧化铝固体,灼烧得到氧化铝;碳酸根水解溶液显碱性,因此向纯碱溶液中滴入几滴酚酞会变红,水解的离子方程式为CO32-+H2O![]() HCO3-+OH-;
HCO3-+OH-;
(2)Ca5(PO4)3OH在唾液中存在下列平衡反应:Ca5(PO4)3OH(s)![]() 5Ca2++3PO43-+OH-,进食后细菌和酶作用于食物产生有机酸,有机酸与OH-反应,H++OH-=H2O,使沉淀溶解平衡向右移动,导致Ca5(PO4)3OH溶解,造成龋齿;
5Ca2++3PO43-+OH-,进食后细菌和酶作用于食物产生有机酸,有机酸与OH-反应,H++OH-=H2O,使沉淀溶解平衡向右移动,导致Ca5(PO4)3OH溶解,造成龋齿;
(3)1g碳与适量水蒸气反应生成CO和H2,需吸收10.94kJ热量,因此1mol碳即12g碳完全燃烧吸收的热量是12×10.94kJ=131.28kJ·mol-1,则此反应的热化学方程式为C(s)+H2O(g)=CO(g)+H2(g)△H=+131.28 kJ·mol-1。


科目:高中化学 来源: 题型:
【题目】某实验室产生的废液中含有Fe3+、Cu2+、Ba2+三种金属离子,研究小组设计了下列方案对废液进行处理,以回收金属,保护环境。

请回答:
(1)步骤①②④用到的主要玻璃仪器是___________________。
(2)步骤③的实验现象是_________________。
(3) 设计一个实验方案,验证步骤①中所加硫酸溶液己经过量____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10 mol·L-1 NaOH溶液分别滴定20.00 mL浓度均为0.10 mol·L-1 CH3COOH溶液和HCN溶液,所得滴定曲线如下图。下列说法正确的是

A. 点①和点②所示溶液中:c(CH3COO-)<c(CN-)
B. 点③和点④所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C. 点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
D. 点②和点③所示溶液中都有:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以充分说明反应P(g)+Q(g)![]() R(g)+S(g)在恒温下已达到平衡的是
R(g)+S(g)在恒温下已达到平衡的是
A. 反应容器内的压强不随时间改变
B. 反应容器内P、Q、R、S四者浓度之比为1:1:1:1
C. P的生成速率和S的生成速率相等
D. 反应容器内的气体总物质的量不随时间变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】5﹣二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成,一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5﹣二甲氧基苯酚的部分物理性质见下表:
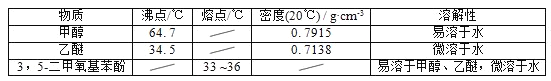
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取,①分离出甲醇的操作是的______;②萃取用到的分液漏斗使用前需__________________并洗净,分液时有机层在分液漏斗的________填(“上”或“下”)层;
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤.用饱和NaHCO3溶液洗涤的目的是__,用饱和食盐水洗涤的目的是______;
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是__(填字母);
a.蒸馏除去乙醚 b.重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤.为了防止倒吸,减压过滤完成后应先________________,再______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述不正确的是
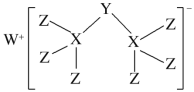
A.W的最高价氧化物是离子化合物
B.该新化合物中X满足8电子稳定结构
C.元素非金属性的顺序为X>Y>Z
D.Z的最高价氧化物的水化物是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源与人类的生存和发展息息相关,化学反应在人类利用能源的历史过程中充当重要的角色。回答下列问题:
(1)科学家最近研制出利用太阳能产生激光,使海水分解。太阳光分解海水时,光能转化为________能,水分解时断裂的化学键是________(填“离子键”或“共价键”)
(2)氢能是一种具有发展前景的理想清洁能源,氢气燃烧时放出大量的热。若断开1mol氢气中的化学键消耗的能量为Q1kJ,断开1mol氧气中的化学键消耗的能量为Q2kJ,形成1mol水中的化学键释放的能量为Q3kJ,则下列关系正确的是____________
A.Q1+Q2<Q3 B.2Q1+Q2<2Q3
C.2Q1+Q2>2Q3 D.Q1+Q2>Q3
(3)下列化学反应在理论上可以设计成原电池的是________。
A.Fe+2FeCl3=3FeCl2 B.SO3+H2O=H2SO4
C.C+H2O![]() CO+H2 D.Ba(OH)2+H2SO4=BaSO4+2H2O
CO+H2 D.Ba(OH)2+H2SO4=BaSO4+2H2O
(4)美国NASA曾开发一种铁·空气电池,其原理如图所示,电池反应为:2Fe+O2+2H2O=2Fe(OH)2。

①电极a为原电池的________(填“正极”或“负极”),该极的电极反应式为______________________;电极b上发生________反应(填“氧化”或“还原”)。
②原电池工作一段时间后,若消耗铁22.4g,则电路中通过的电子数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)画出下列元素的原子结构示意图。
①核电荷数为13的元素:_______。
②最外层电子数等于次外层电子数的元素原子:______。
(2)现有粒子:1H、35Cl、2H、14N、2H37Cl,其中:
①有_________种元素;
②__________之间互称同位素。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,属于氧化还原反应的是
A.Al2O3+6HCl=2AlCl3+3H2O
B.Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
C.2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
D.SiO2+2NaOH=Na2SiO3+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com