
【题目】用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是( )
A.![]()
B.![]()
C.c(H+)和c(OH﹣)的乘积
D.OH﹣的物质的量
【答案】B
【解析】解:A、由NH3 . H2OOH﹣+NH4+可知,加水促进电离,则n(NH3 . H2O)减少,n(OH﹣)增大, ![]() 增大,故A错误; B、由NH3 . H2OOH﹣+NH4+可知,加水促进电离,则n(NH3 . H2O)减少,n(OH﹣)增大,
增大,故A错误; B、由NH3 . H2OOH﹣+NH4+可知,加水促进电离,则n(NH3 . H2O)减少,n(OH﹣)增大, ![]() 减小,故B正确;
减小,故B正确;
C、因加水稀释时,温度不变,则c(H+)和c(OH﹣)的乘积不变,故C错误;
D、由NH3 . H2OOH﹣+NH4+可知,加水促进电离,OH﹣的物质的量增大,故D错误;
故选:B.
用水稀释0.1mol/L氨水时,溶液中随着水量的增加,由NH3 . H2OOH﹣+NH4+可知,n(OH﹣)增大,但溶液的体积增大的多,则c(OH﹣)减小,加水促进电离,则n(NH3 . H2O)减少.


科目:高中化学 来源: 题型:
【题目】某Na2O2 固体中因吸收CO2 而含有少量Na2CO3,经实验测定样品中Na2O2的质量分数为88.0%。现称取该样品8.86g,加入水充分反应后放出气体,所得溶液体积为500mL。试计算:(要求:写出解题过程,计算结果保留两位小数)
(1)上述反应所得气体在标准状况下的体积;_________
(2)反应后溶液中Na+的物质的量浓度。_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意解答
(1)某温度下,在Ca(OH)2(Ksp=5.5×10﹣6)、Mg(OH)2(Ksp=3.2×10﹣11)、AgCl(Ksp=1.8×10﹣10)三种物质中,溶解度最小的是
(2)在粗制CuSO45H2O晶体中常含有杂质Fe2+ . 在提纯时为了除去Fe2+ , 常加入氧化剂,使Fe2+氧化为Fe3+ , 下列物质最合适的是 A.KMnO4 B.H2O2 C.Cl2 水 D.HNO3
已知KMnO4氧化Fe2+时,生成Mn2+离子,试写出酸性KMnO4与Fe2+反应的离子反应方程式;然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3 , 可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的
A.NaOH B. NH3H2O C.CuCO3 D.Cu(OH)2
(3)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10﹣38 , Cu(OH)2的溶度积Ksp=3.0×10﹣18 , 通常认为残留在溶液中的离子浓度小于1×10﹣5 molL﹣1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0molL﹣1 , 则Cu(OH)2开始沉淀时溶液的pH为 , Fe3+完全沉淀时溶液的pH为(已知lg2=0.3,lg5=0.7),通过计算确定上述方案(填“可行”或“不可行”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物分子中的基团之间存在着相互影响.
(1)在甲烷、苯、甲苯这三种物质中,可以使酸性高锰酸钾溶液褪色的有(填名称),能用于制取炸药梯恩梯(TNT)的是(填分子式).
(2)某学习小组通过实验探究①苯酚、②醋酸、③碳酸这三种物质分子中的羟基在水中电离能力的强弱.主要实验步骤如下: a、取三支试管,分别加入三种物质的水溶液(适量),再分别滴加2~3滴紫色石蕊试液,发现仅②、③的溶液变红.
b、另取一支试管,加入少量滴加了酚酞的NaOH溶液,再滴加①的溶液,发现试管中溶液的红色明显变浅.
c、再取一支试管,加入少量碳酸钠溶液,向其中滴加②的溶液,发现有气体生成.
d、将CO2气体通入苯酚钠的水溶液中,发现溶液变浑浊.
请回答以下问题:
①步骤b的现象说明苯酚具有性.
②步骤d中,发生反应的化学方程式为 .
③三种物质分子中的羟基在水中的电离能力由强到弱的顺序是(填序号).
④在苯酚分子中,羟基对苯基的性质也有影响.写出苯酚与浓溴水反应生成的有机产物的结构简式: .
(3)同学甲设计了如右图所示的实验装置一次性地验证苯酚、醋酸、碳酸的酸性强弱.同学乙认为该实验装置设计的不严密,理由是 . 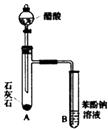
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向1L密闭容器中加入1mol HI(g),发生反应2HI(g)H2(g)+I2(g),2s时生成0.1mol H2 , 则以HI表示该时段的化学反应速率是( )
A.0.05 molLˉ1sˉ1
B.0.1 molLˉ1sˉ1
C.0.2 molLˉ1sˉ1
D.0.8 molLˉ1sˉ1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯是重要的有机化工原料,主要用于生产聚丙烯、丙烯腈、环氧丙烷等。
(1)以丁烯和乙烯为原料制备丙烯的方法被称为“烯烃歧化法",主要反应为C4H8(g)+C2H4(g) ![]() 2C3H6(g)
2C3H6(g)
已知相关燃烧热数据:
C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) △H1=-1411kJ·mol-1
C3H6(g)+ ![]() O2(g)=3CO2(g)+3H2O(l) △H2=-2049kJ·mol-1
O2(g)=3CO2(g)+3H2O(l) △H2=-2049kJ·mol-1
C4H8(g)+6O2(g)=4CO2(g)+4H2O(l) △H3=-2539kJ·mol-1
①乙烯的电子式为。
②相同质量的C2H4(g)、C3H6(g)和C4H8(g)充分燃烧,放出的热量由多到少的顺序依次为(填写化学式)。
③ 上述“烯烃歧化法”的反应的热化学方程式为。
(2)“丁烯裂解法”是另一种重要的丙烯生产法,生产过程中会有生成乙烯的副反应发生。
反应如下:主反应:3C4H8 ![]() 4C3H6;副反应:C4H8
4C3H6;副反应:C4H8 ![]() 2C2H4
2C2H4
测得上述两反应的平衡体系中,各组分的质量分数(w%)随温度(T)和压强(p)变化的趋势分别如图1和图2所示: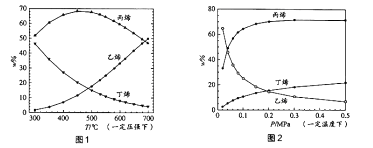
①平衡体系中的丙烯和乙烯的质量比[ ![]() ]是工业生产丙烯时选择反应条件的重要指标之一,从产物的纯度考虑,该数值越高越好,从图1和图2中表现的趋势来看,下列反应条件最适宜的是(填字母序号)
]是工业生产丙烯时选择反应条件的重要指标之一,从产物的纯度考虑,该数值越高越好,从图1和图2中表现的趋势来看,下列反应条件最适宜的是(填字母序号)
A. 300℃ 0.1MPa B. 700℃ 0.1MPa
C.300℃ 0.5MPa D.700℃ 0.5MPa
②有研究者结合图1数据并综合考虑各种因素,认为450℃的反应温度比300℃或700℃更合适,从反应原理角度分析其理由可能是。
③图2中,随压强增大,平衡体系中丙烯的质量分数呈上升趋势,从平衡角度解释其原因是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、D、E、W是中学常见的四种元素,原子序数依次增大。A的原子最外层电子数是次外层的2倍,D的氧化物属于两性氧化物,D、E位于同周期,A、D、E的原子最外层电子数之和为14,W是人体必需的微量元素,缺乏W会导致贫血症状。
(1)A在元素周期表中的位置是。
(2)下列事实能用元素周期律解释的是(填字母序号)。
a . D的最高价氧化物对应水化物的碱性弱于Mg(OH)2
b. E的气态氢化物的稳定性小于HF
c. WE3的溶液可用于刻蚀铜制的印刷电路板
(3)E的单质可以从NaBr溶液中置换出Br2单质,从原子结构的角度解释其原因是。
(4)①工业上用电解法制备D的单质,反应的化学方程式为。
②家用“管道通”的有效成分是烧碱和D的单质,使用时需加入一定量的水,此时发生反应的化学方程式为。
(5)W的单质可用于处理酸性废水中的NO3- , 使其转换为NH4+ , 同时生成有磁性的W的氧化物X,再进行后续处理。
① 上述反应的离子方程式为。
② D的单质与X在高温下反应的化学方程式为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.难失电子的原子,获得电子的能力一定强
B.易得电子的原子所形成的简单阴离子,其还原性一定强
C.活泼金属与活泼非金属化合,易形成离子键
D.电子层结构相同的不同离子,核电荷数越多,半径越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯水中c(H+ )=5.0×10﹣7 mol/L,则此时纯水中的c(OH﹣)=;若温度不变,滴入稀硫酸使c(H+)=5.0×10﹣3mol/L,则c(OH﹣)=;在该温度时,往水中滴入NaOH溶液,溶液中的c(OH﹣)=5.0×10﹣2 mol/L,则溶液中c(H+ )= .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com